A colloquio con l’esperto, Dr. Tommaso Lupattelli, pioniere nella diagnosi e trattamento di patologie venose rare come la Sindrome di May-Thurner o di Nutcracker.
Dr Lupattelli, Lei da anni si occupa di varicocele femminile, più propriamente chiamato sindrome da congestione pelvica. In alcuni casi questa affezione può associarsi ad una compressione della vena renale sinistra che può comportare, come campanello d’allarme un dolore importante al fianco sinistro e/o evidenza di sangue nelle urine.
La compressione della vena renale sinistra ( VRS) o Sindrome di Nutcracker è sindrome che recentemente la comunità scientifica ha cominciato sempre meglio ad individuare e riconoscere in modo da arrivare finalmente ad una corretta diagnosi del fenomeno, purtroppo per molti anni troppo spesso sottovalutato oltre che misconosciuto.
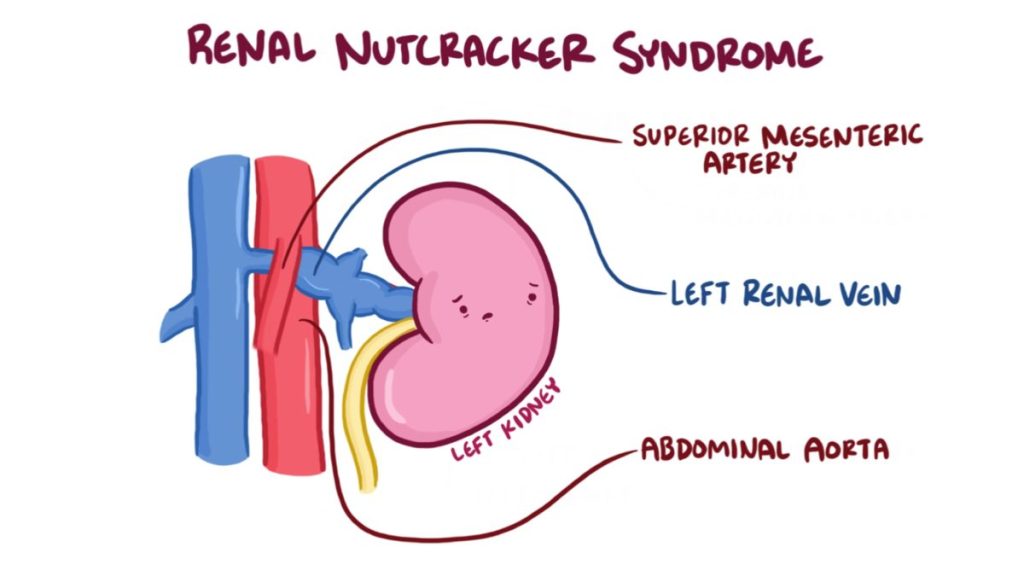
Descritta per la prima volta già nel 1937 è dovuta generalmente al passaggio dell’ arteria mesenterica superiore al di sopra della VRS (1,2) . In alcuni casi, la compressione della vena può portare ad una dilatazione clinicamente rilevante del sua porzione più distale in associazione ad un gradiente pressorio significativo ( ovvero una differenza della pressione del sangue) tra il segmento della vena prima e dopo la compressione. (Figura 1).
Le caratteristiche importanti associate a questo difetto anatomico sono state, negli anni, riconosciute ed alla fine hanno preso il soprannome di fenomeno a “schiaccianoci“.
È poi presente una sindrome analoga, descritta in pazienti con una VRS posizionata in sede retroaortica, il che può comportare una compressione della vena tra la stessa aorta e la colonna vertebrale (3) . Con questa nuova descrizione, è diventato quindi necessario riferirsi ad una compressione della VRS ante-aortica da parte dell’ arteria mesenterica superiore come “sindrome da schiaccianoci anteriore” e una compressione della VRS retroaortica come “sindrome da schiaccianoci posteriore“.
Con appena poche unità di casi noti di quest’ultima sindrome, la compressione retroaortica fu descritta per la prima volta nel 1986 (5) . Tuttavia, come in parte già specificato, la configurazione anteriore rimane altamente più comunemente osservata (6).
La prima descrizione della riparazione chirurgica nell’ ottica di migliorare il deflusso all’interno della VRS fu pubblicata nel 1974 (7), e da allora, l’approccio al trattamento ma anche e soprattutto alla diagnosi del sospetta compressione della VRS si è continuamente evoluto.
Nonostante l’incidenza di questa affezione sia rara, fino al 50-75% di bambini del tutto asintomatici ma anche un numero, seppur limitato, di soggetti adulti possono presentare un certo grado di compressione della VRS e dilatazione come reperto collaterale in studi di imaging ( generalmente eseguiti per altre patologie) senza tuttavia mostrare alcun problema di carattere clinico.
Alcuni autori hanno messo in evidenza la possibile presenza di una variabile, ancora sconosciuta, che potrebbe predisporre i pazienti a manifestare sintomi di ipertensione venosa renale a differenza di altri (8-9) .
E’ infatti noto che la legatura elettiva della VRS durante un intervento di aneurisma dell’ aorta addominale è ben tollerata nella maggior parte dei casi pertanto una compressione esterna della VRS è probabile metta in atto meccanismi di compenso che diminuiscono fortemente la sua rilevanza sul piano anatomico e clinico in molti pazienti (10-12).
Quali sono i pazienti maggiormente affetti dalla sindrome di Nutcracker e nello specifico quali sono i sintomi che vi si associano?
Il complesso dei sintomi correlato alla sindrome dello schiaccianoci si riferisce all’ ipertensione venosa relativa alla compressione della VRS.
La sindrome è più comunemente osservata in uomini giovani e magri e donne di mezza età ma può comparire spesso anche in donne molto giovani. In genere si manifesta come un dolore al fianco sinistro con possibile ematuria, la cui gravità può variare da un reperto microscopico osservato all’analisi delle urine fino all’ ematuria macroscopica con necessità nei casi più severi anche di una trasfusione ematica [13].
L’ematuria è probabilmente causata dalla rottura a livello microvascolare nella circolazione renale [14,15].
I sanguinamenti possono anche essere intermittenti e probabilmente correlati ad un relativo aumento del pressione venosa che può peggiorare i sintomi dopo sforzo fisico o mantenimento della posizione eretta per un periodo prolungato (16) .
L’aumento di pressione nel circuito venoso gonadico può alla fine condurre a reflusso, dilatazione , varici e collateralizzazione dei vasi venosi pelvici. La presenza di coinvolgimento della vena gonadica sinistra è la caratteristica distintiva della cosiddetta “sindrome da congestione pelvica” (SCP)( più comunemente chiamato varicocele ) (Fig 2), che si manifesta come dilatazione delle vene peritesticolari del lato sinistro ( piu’ raramente anche destra) nei giovani uomini e dolore cronico al basso ventre o pelvico e dispareunia nelle donne. [18,19].
In uno studio abbastanza recente, una serie di 51 pazienti di sesso femminile con sintomi correlati alla SCP ( che presentavano in modo variabile varici glutee, vulvari e degli arti inferiori), nove pazienti (17%) presentavano ulteriori sintomi come ematuria e dolore al fianco sinistro. [19].
Gli autori concludevano che tutti i pazienti con una SCP e che presentano in concomitanza anche ematuria dovrebbero essere sottoposti a valutazione diagnostica per possibile presenza della compressione della VRS.
La sindrome da compressione della LRV è anche ben descritta nei bambini, sebbene sia tipicamente di natura autolimitante in questa popolazione.
Il trattamento nei bambini dovrebbe quindi essere, per quanto possibile, sempre posticipato nel tempo in attesa di una probabile risoluzione spontanea della compressione della VRS. [20, 21].
Come si può diagnosticare la compressione della vena renale sinistra?
La diagnosi viene posta in seguito ad un esame di imaging ( ecografia o TC con mezzo di contrasto) della VRS, previa valutazione clinica accurata dei sintomi e dei segni del paziente (fig 3a e 3b).
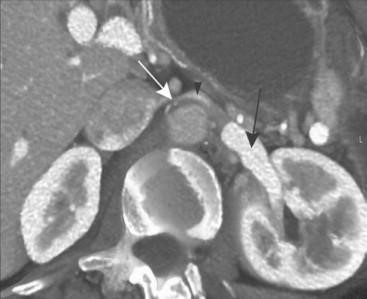
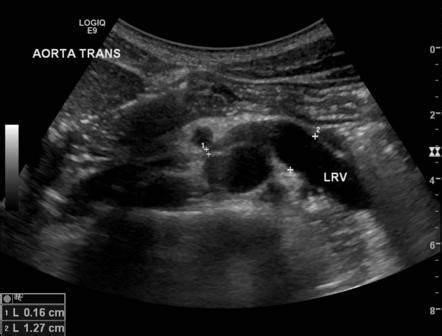
Evidenza di compressione della vena renale sinistra tra aorta e arteria mesenterica superiore (freccia bianca nella immagine 3a)
Quando un giovane uomo o una donna di mezza età presenta sintomi relativi alla compressione della VRS, è altresì fondamentale eseguire un’attenta diagnosi differenziale. La compressione della VRS dovrebbe essere differenziata dalla presenza di altre rare malattie da compressione intra-addominale come per esempio la sindrome del legamento arcuato mediano o la compressione vascolare del duodeno.
Infatti non di rado, la diagnosi corretta di sindrome di Nutcracker viene raggiunta solo molti anni dopo la presentazione iniziale dei sintomi.
La cistoscopia può essere di ausilio nella diagnosi di compressione della vena renale sinistra o possiamo avvalerci di indagini ancora più accurate?
La conferma di ematuria ureterale sinistra isolata alla cistoscopia suggerisce una ipertensione venosa omolaterale, ma si tratta tuttavia spesso di un test poco attendibile a causa della natura intermittente e potenzialmente microscopica del ematuria.
Viceversa, la tomografia computerizzata o TC, l’ angiografia a risonanza magnetica e la flebografia sono validi strumenti diagnostici per valutare i vari criteri di inclusione necessari alla diagnosi di compressione/dilatazione della VRS ed escludere altri problemi di natura renale o addominale .
Inoltre, la valutazione dell’angolo aorto-mesenterico può essere individuato alla TC o alla RM tramite scansioni sia in sagittale che in sezione assiale. In genere, questo angolo dovrebbe risultare essere >35° nei soggetti normali, mentre ha mostrato essere negli individui francamente affetti di circa 16° o in certi casi anche meno di 16° [22] ( fig 4 ).
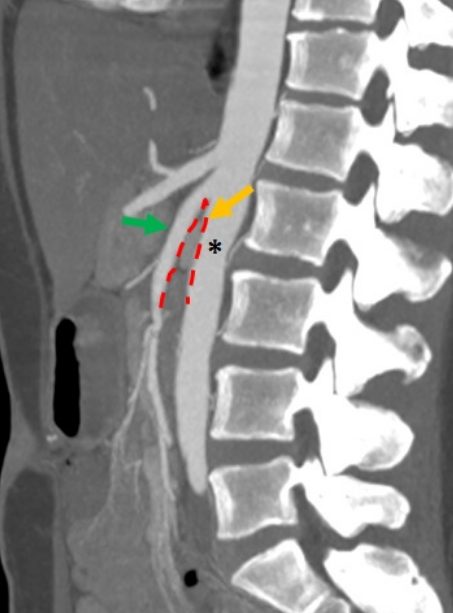
Fig 4. Esame TC con ricostruzione MIP. L’asterisco indica l’arteria aorta, la freccia verde l’arteria mesenterica inferiore e la freccia gialla un angolo aorto mesenterico < 16 °.
E’ importante sottolineare che lo studio di imaging nella sola sezione assiale o trasversale non consente da solo di giungere ad una diagnosi certa, poiché un certo grado di compressione della vena renale può rappresentare una normale variante anatomica in una parte consistente della popolazione sia pediatrica che adulta. [8].
Infine, in mani esperte lo stesso eco color Doppler, esame sicuramente più accessibile per il paziente, è metodica sensibile e accurata per identificare un aumentata velocità all’interno della vena renale di sinistra a livello dell’angolo aorto-mesenterico[22,23]. Una ratio della velocità del picco sistolico venoso fra il segmento pre e quello post compressione della vena renale sinistra è un indice attendibile per caratterizzare la sindrome.
In generale, una ratio della velocità del picco sistolico venoso > 4,7 ha sia una sensibilità che una specificità > 90% per la diagnosi della sindrome da compressione venosa della VRS all’esame eco color doppler [24].
Di tutte le tecniche diagnostiche ad oggi quale è quella maggiormente attendibile per la diagnosi della sindrome di Nutcracker?
Allo stato attuale, la diagnosi definitiva di compressione della VRS in individui sintomatici si basa ancora sull’ esame flebografico con evidenza di un gradiente pressorio significativo fra il segmento venoso pre e quello post compressione ( gradiente reno-cavale > 3 mm hg) (25,26).
Da notare tuttavia che la posizione del paziente può comportare delle intervariabilità nelle varie misurazioni della pressione come anche dimostrato da alcuni recenti studi (17). Ovviamente prima di arrivare alla flebografia il paziente dovrebbe aver eseguito almeno un eco-color doppler e ancora meglio una TC o una RM con mdc.
Ad oggi, Dr. Lupattelli, esistono presidi validi per curare questa patologia dove il suo Team risulta sicuramente all’avanguardia nel panorama sia nazionale che internazionale. Quali sono le principali tecniche che si possono offrire attualmente al paziente?
Principalmente le opzioni di trattamento per la sindrome da compressione della LRV consistono nella chirurgica a cielo aperto mediante trasposizione della vena compressa (27-29) o, quando possibile, nell’approccio mininvasivo endovascolare mediante posizionamento di stent (30-34).
La decisione di intervenire e con quale metodo deve essere presa in base anche e soprattutto alle caratteristiche anatomiche della compressione della VRS . Come in precedenza menzionato, nella popolazione pediatrica la crescita dell’individuo tende nel tempo a ridurre sensibilmente la gravità del fenomeno che quindi quasi sempre si autolimita nel tempo.
La scelta endovascolare con impianto di stent da parte del radiologo interventista rende il trattamento della compressione della VRS sicuramente molto più agevole rispetto all’intervento di chirurgia open dove invece sia la degenza che il post operatorio risultano inevitabilmente impegnativi.
Il posizionamento di uno stent presuppone che la paziente, dopo una semplice anestesia locale ( come dal dentista) venga trattata eseguendo un forellino di 3 mm all’ inguine o alla piega del gomito utilizzando un normalissimo ago da prelievo.
Attraverso il forellino praticato con questo ago il radiologo inserisce poi un piccolissimo tubicino chiamato catetere vascolare con cui andrà ad iniettare mezzo di contrasto all’interno della VRS per visualizzarne il decorso e il grado di compressione della VRS.
Una volta calcolate accuratamente le misure interne della VRS, valutata la conformazione anatomica del vaso e misurato il gradiente pressorio al suo interno ( mediante misurazioni pressorie sia a valle che a monte della compressione venosa) così da poter confermare la diagnosi di compressione emodinamicamente significativa, il radiologo posizionerà uno stent dotato di una buona forza radiale (nell’ottica di ottenere un ottimale riapertura della vena) a livello del segmento compresso (Fig 5).
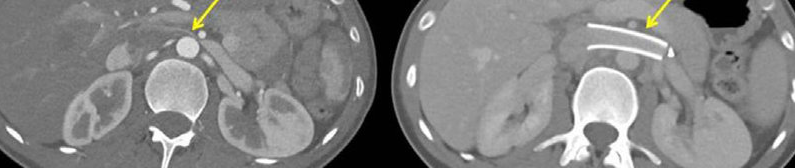
La manovra consentirà un immediata normalizzazione dei valori pressori all’interno della VRS con verosimile cessazione della sintomatologia correlata.
Nella stessa seduta il radiologo potrà infine andare a valutare anche l’eventuale presenza di una congestione pelvica e se necessario eseguire l’intervento di sclero-embolizzazione .
Tuttavia è assolutamente fondamentale che questo intervento, sicuro ed efficace in mani esperte, venga esclusivamente eseguito da un team veramente esperto nel campo endovascolare e con grande esperienza di posizionamento di stent in questo specifico distretto.
Lavinia Giganti, redazione, in collaborazione con il Dott. Tommaso Lupattelli Chirurgo Interventista
Bibliografia
- 1. Grant JCB. Methods of Anatomy. (Ed.). Williams & Wilkins.MD, USA (1937).
- 2. El-Sadr AR, Mina E. Anatomical and surgical aspects in the operative management of varicocele. Urol. Cutaneous. Rev. 54, 257–262 (1950).
- 3. Chait A, Matasar KW, Fabian CE et al. Vascular impressions on the ureters. Am. J. Roentgenol. Radiat. Ther. 111, 729–749 (1971).
- 4. De Schepper A. ‘Nutcracker’ fenomeen van de vena renalis en veneuze pathologie van de linkder nier [in Belgian]. J. Belge. Radiol. 55,507–511 (1972).
- 5. Lau JL, Lo R, Chan FL, Wong KK. The posterior “nutcracker”: hematuria secondary to Lau JL, Lo R, Chan FL, Wong KK. The posterior “nutcracker”: hematuria secondary to retroaortic left renal vein. Urology 28, 437–439 (1986).
- 6. Marone EM, Psacharopulo D, Kahlberg A et al. Surgical treatment of posteriornutcracker syndrome. J. Vasc. Surg. 54(3), 844–847 (2011).
- 7. Pastershank SP. Left renal vein obstruction by a superior mesenteric artery. J. Can. Assoc. Radiol. 25, 52–54 (1974).
- 8. Buschi AJ, Harrison RB, Brenbridge ANAG et al. Distended left renal vein: CT/sonographic normal variant. AJR Am. J. Roentgenol. 135, 339–342 (1980).
- 9. Zerin JM, Hernandez RJ, Sedman AB et al. ‘Dilatation’ of the left renal vein on computed tomography in children: a normal variant. Pediatr. Radiol. 21, 267–269 (1991).
- 10. Mehta T, Wade RG, Clarke JMF. Is it safe to ligate the left renal vein during open abdominal aortic aneurysm repair? Ann. Vasc. Surg. 24, 758–761 (2010).
- 11. Choi SH, Hwang HK, Kang CM et al. Potential use of left renal vein graft in pancreaticoduodenectomy combined with long segmental resection of the superior mesenteric–splenic– portal vein confluence. JOP 12, 234–240 (2011).
- 12. Ohwada S, Hamada K, Kawate S et al. Left renal vein graft for vascular reconstruction in abdominal malignancy. World J. Surg. 31, 1215–1220 (2007).
- 13. Venkatachalam S, Bumpus K, Kapadia SR et al. The nutcracker syndrome. Ann. Vasc. Surg. DOI: 10.1016/j.avsg.2011.01.002(2011) (Epub ahead of print).
- 14. Hayashi M, Kume T, Nihira H. Abnormalities of renal venous system and unexplained renal hematuria. J. Urol. 124, 12–16 (1980).
- 15. Beinart C, Sniderman KW, Saddekni S et al. Left renal vein hypertension: a cause of occult hematuria. Radiology 145, 647–650 (1982).
- 16. Kurklinsky AK, Rooke TW. Nutcracker phenomenon and nutcracker syndrome. Mayo. Clin. Proc. 85, 552–559 (2010).
- 17. Fitoz S, Ekim M, Ozcakar ZB et al. Nutcracker syndrome in children: the role of upright position examination and superior mesenteric artery angle measurement in the diagnosis. J. Ultrasound Med. 26, 573–580 (2007).
- 18. Maleux G, Stckx L, Wilms G et al. Ovarian vein embolization for the treatment of pelvic congestion syndrome: long-term technical and clinical results. JVIR 11, 859–864 (2000).
- 19. Scultetus AH, Villavicencio JL, Gillespie DL. The nutcracker syndrome: its role in the pelvic venous disorders. J. Vasc. Surg. 34, 812–819 (2001).
- 20. Tanaka H, Waga S. Spontaneous remission of persistent severe hematuria in an adolescent with nutcracker syndrome: seven years’ observation. Clin. Exp. Nephrol. 8, 68–70 (2004).
- 21. Shin JI, Park JM, Lee SM. Factors affecting spontaneous resolution of hematuria in childhood nutcracker syndrome. Pediatr. Nephrol. 20, 609–613 (2005).
- 22. Arima M, Hosokawa S, Ogino T et al. Ultrasonographically demonstrated nutcracker phenomenon: alternative to angiography. Int. Urol. Nephrol. 22, 3–6 (1990).
- 23. Cheon JE, Kim WS, Kim IO et al. Nutcracker syndrome in children with gross haematuria: Doppler sonographic evaluation of the left renal vein. Pediatr. Radiol. 36, 682–686 (2006).
- 24. Reed NR, Kalra M, Bower TC et al. Left renal vein transposition for nutcracker syndrome. J. Vasc. Surg. 49, 386– 393 (2009).
- 25. Zerhouni EA, Siegelman SS, Walsh PC et al. Elevated pressure in the left renal vein in patients with varicocele: preliminary observations. J. Urol. 123, 512–513 (1980).
- 26. Beinart C, Sniderman KW, Tamura S et al. Left renal vein to inferior vena cava pressure relationship in humans. J. Urol.127, 1070–1071 (1982).
- 27. Chung BK, Gill IS. Laparoscopic splenorenal venous bypass for nutcracker syndrome. J. Vasc. Surg. 49, 1319–1323 (2009)
- 28. Stewart BH, Reiman G. Left renal venous hypertension ‘nutcracker’ syndrome. Managed by direct renocaval reimplantation. Urology 20, 365–369 (1982).
- 29. Salehipour M, Khexri A, Rasekhi A et al. Left renal vein transposition for treatment of the nutcracker syndrome. Arch. Iran. Med. 9, 161–166 (2006).
- 30. Neste MG, Narasimham DL, Belcher KK. Endovascular stent placement as a treatment for renal venous hypertension. J. Vasc. Interv. Radiol. 7, 859–861 (1996)
- 31. Chen W, Chu J, Yang J et al. Endovascular stent placement for the treatment of nutcracker phenomenon in three pediatric patients. JVIR 16, 1529–1533 (2005).
- 32. Zhang H, Shang N, Li M. Treatment of six cases of left renal nutcracker phenomenon: surgery and endografting. Chin. Med. J. 116, 1782–1784 (2003).
- 33. Zhang H, Li M, Jin W, San P, Xu P, Pan S. The left renal entrapment syndrome: diagnosis and treatment. Ann. Vasc. Surg. 21, 198–203 (2007).
- 34. Hartung O, Grisoli D, Boufi M et al. Endovascular stenting in the treatment of pelvic vein congestion caused by nutcracker syndrome: lessons learned from the first five cases. J. Vasc. Surg. 42, 275–280 (2005).
SI PREGA DI INDICARE IL PROPRIO NOME E QUELLO DEL DESTINATARIO DELLA RICHIESTA.
Le richieste saranno inoltrate al medico o professionista sanitario il quale risponderà direttamente. DossierSalute.com non è responsabile di tardive o mancate risposte.