Introduzione
Le patologie ulcerative del cavo orale comprendono quadri clinici assai diversi, che si differenziano per eziopatogenesi, manifestazioni cliniche, modalità diagnostiche, prognosi e terapia. Essendo tali patologie numerose ed avendo ciascuna di loro diversa origine e sviluppo con caratteristiche proprie, anche i criteri di differenziazione che lo specialista deve adottare in ognuno di questi casi sono molteplici e non sempre di facile interpretazione.
Le condizioni che determinano la formazione di ulcere nel cavo orale sono varie. Una completa classificazione si estende dalle ulcerazioni traumatiche alle malattie infettive, dalle reazioni farmacologiche alle malattie autoimmuni e allergiche (Tabella I).
Tabella I – Condizioni determinanti la formazione di ulcere orali.
|
Ulcere aftose |
Reazioni farmacologiche |
|
Noma |
TBC |
|
Sindrome di Behçet |
Allergie da contatto |
|
LES |
Actinomicosi |
|
Sindrome di Reiter |
Eritema multiforme |
|
Micosi |
Lebbra |
|
Lesioni reattive |
Granulomatosi di Wegener |
| Sifilide – Gonorrea |
Lichen Planus |
Troppo spesso constatiamo il fatto che ad alcuni dei pazienti che giungono presso il nostro Servizio di Patologia Orale, in qualche caso dopo aver compiuto delle vere e proprie peregrinazioni presso vari presìdi odontostomatologici. Vengono prescritti e somministrati farmaci ancor prima di aver formulato la diagnosi, con conseguente disagio per il paziente, inquinamento dell’effettivo quadro clinico e sintomatologico insorto (la sintomatologia può infatti migliorare anche a seguito della risoluzione delle flogosi sovrapposte). Tutto ciò comporta delle difficoltà nel riconoscere l’effettiva tipologia della patologia in atto e, specie per le lesioni neoplastiche, pericoloso ritardo diagnostico derivante (10). Riteniamo che i medici di base e tutti coloro i quali operino in strutture di primo livello debbano essere edotti a tale proposito. Quindi, secondo le direttive dell’OMS, nella pratica clinica quotidiana devono essere considerate in modo sospetto tutte le lesioni orali non regredite spontaneamente entro quindici giorni (59).
Per il successo diagnostico-terapeutico risulta fondamentale formulare un’accurata diagnosi, escludendo tutte le patologie che possono entrare in diagnosi differenziale, e adottare una condotta clinico-terapeutica appropriata in relazione alla patologia diagnosticata.
Lo scopo di questa monografia è quello di fornire criteri utili, che possano aiutare l’odontoiatra nella pratica clinica quotidiana a riconoscere e distinguere le patologie ulcerative del cavo orale di più comune riscontro, per non incappare in grossolani e pericolosi errori di valutazione.
Quadri clinici
Per ulcerazione si intende la perdita dell’epitelio superficiale (3) (53). Istologicamente, la superficie è ricoperta da una massa di fibrina con frammisti polimorfonucleati morti o morenti, che sulla cute dovrebbero seccarsi e formare una crosta o un’escara. Nel cavo orale, invece, costantemente umido, formano una squamatura che ricopre il pavimento dell’ulcera.
Risulta quindi basilare esaminare attentamente la superficie delle ulcere, perchè talvolta è possibile che l’epitelio venga danneggiato da una vescicolazione subepiteliale, come ad esempio nel pemfigoide mucoso. Quindi, un’ulcera superficiale senza evidenze di una significativa essudazione fibrinosa presente sulla superficie, o di una migrazione di polimorfonucleati, suggerisce la possibilità di un disturbo di tipo bolloso, in particolare nel caso in cui il sospetto sia supportato dalla clinica (38 53).
Vengono di seguito esaminati alcuni quadri clinici di più comune riscontro nella pratica odontoiatrica.
Afte ricorrenti
Da un punto di vista morfologico l’afta è caratterizzata da una o più erosioni o ulcere, che possono risultare di forma ovalare o circolare, a margini netti e ben definiti. Possono essere singole o multiple, rivestite da uno strato di fibrina pseudomembranoso ben aderente, circondate da una zona marginale molto rossa, e sempre dolorose. Tuttavia, non tutte le ulcere rivestite di fibrina sono considerabili come afte. E’ pertanto importante ricordare che le ulcere rappresentano spesso un’alterazione secondaria che può essere determinata da molteplici cause.

Tutte le lesioni aftose hanno in comune una persistente tendenza alla recidiva, con intervalli temporali mutevoli ed una guarigione spontanea. Il quadro clinico, la storia precedente e il decorso, rappresentano quindi i criteri decisivi per la diagnosi clinica delle afte (20).
Le ulcere aftose ricorrenti possiedono un carattere patologico locale, rimangono limitate alla mucosa orale, sono innocue seppur durature e talvolta molto fastidiose. Esse rappresentano la patologia della mucosa orale che più frequentemente viene osservata nell’ambito dell’attività clinica odontostomatologica.
Epidemiologicamente colpiscono circa il 30% della popolazione, con un picco di incidenza fra i 20 e i 50 anni. Rappresentano quindi un disturbo molto diffuso, di natura non infettiva (da cui la distinzione con la gengivo-stomatite erpetica e l’herpes simplex erosivo), e ad eziologia sconosciuta, anche se si suppone che non sia univoca. Un fattore scatenante sembra possa essere attribuito a carenze di ferro, di vitamina B12, di acido folico, o ad infezioni batteriche (Streptococco sanguis e mitis) o virali.
Fattori favorenti sono invece considerati i traumi, le allergie al nichel, le endocrinopatie, lo stress emotivo, l’instabilità neurovegetativa (angioneurosi), il sistema endocrino (cicli mestruali, gravidanza), le disfunzioni gastrointestinali (dispepsia), un particolare assetto genetico predisponente (HLA B51, B27 e B12), e la presenza di anticorpi IgG e IgM contro antigeni citoplasmatici della mucosa orale (ipotesi autoimmunologica mediata dai linfociti – heat shock proteins).
In alcuni pazienti, data la tendenza alla recidiva di questa patologia, può divenire un problema capace di durare decenni o tutta la vita. La prima comparsa si verifica in genere nel periodo compreso tra il decimo ed il ventesimo anno di vita, con una prevalenza nei soggetti adulti giovani o di età media e di sesso femminile, eccezionalmente anche in età infantile. La malattia si manifesta clinicamente con la comparsa di una sensazione puntoria caratteristica che colpisce un punto delimitato, cui segue un eritema crescente.
Nel centro della lesione si forma un piccolo nodulo, talvolta vescicolare, quasi mai osservabile clinicamente vista la breve durata. Aumentando l’essudazione infiammatoria, si giunge ad una necrosi dell’epitelio: l’erosione, o la poco più profonda ulcera, viene accompagnata da un dolore urente notevole. Il quadro aftoso si è così praticamente espresso, e si caratterizza per un’ulcera posta al centro di una zona eritematosa infiltrata, ricoperta da uno strato di fibrina biancastro o giallastro ben aderente. Il difetto della mucosa rimane perlopiù limitato alle dimensioni di una lenticchia, e solo in casi eccezionali raggiunge le dimensioni di un centimetro di diametro.
Le afte più frequenti, o afte di Mikulicz, si manifestano in modo isolato e in numero ridotto, e più di 5 lesioni presenti contemporaneamente risultano una rarità. Le lesioni mucose dopo circa 6-8 giorni si riepitelizzano a partire dai margini, guarendo normalmente nell’arco di 10-14 giorni senza lasciare cicatrici. Sono colpite le regioni non cheratinizzate del cavo orale, in particolare la mucosa geniena e labiale, il pavimento orale anteriore, la parte ventrale della lingua ed i margini. Di più raro riscontro è l’insorgenza di una lesione aftosica in corrispondenza di una superficie mucosa masticatoria, come il dorso linguale, il palato duro e la gengiva propria, solitamente non interessate.
Il tabagismo accresce la cheratinizzazione della mucosa, qiundi l’abitudine al fumo sembra contrastare l’insorgenza delle ulcere aftose ricorrenti. Nonostante la cronicità della malattia, il decorso delle singole lesioni è acuto.
Gli intervalli asintomatici possono variare da alcuni giorni, a settimane o a mesi, potendo giungere fino ad anni. Quadro clinico, attento esame obiettivo, ed accurata anamnesi consentono di formulare una diagnosi pressochè certa. L’esame citologico mette eventualmente in evidenza epiteliociti più o meno alterati, ma mai in senso acantolitico o balloniforme. Il termine di stomatite aftosa può fuorviare e confondere la diagnosi di gengivostomatite erpetica (causata dall’Herpes Simplex Virus).
Alcuni autori suggeriscono pertanto di abbandonare questa dizione in modo definitivo, questo soprattutto in considerazione del fatto che i sintomi non patognomonici e caratteristici dell’infezione sostenuta dall’Herpes Virus mancano nelle ulcere aftose ricorrenti (20) (53). In diagnosi differenziale rientrano quindi la stomatite erpetica, l’erpangina, l’eritema multiforme e le reazioni da farmaci, come spesso oggi capita di vedere soprattutto nei soggetti sottoposti a lunghe terapie antibiotiche a causa delle infezioni da Helicobacter Pilory.
Una forma ulteriore attraverso cui possono manifestarsi clinicamente le ulcere aftose ricorrenti è rappresentata dalle cosiddette afte di tipo major, note anche come afte di Sutton, o di periadenite mucosa necrotica ricorrente. Si tratta di afte giganti, con un diametro variabile tra 1 e 3 centimetri, che compaiono generalmente in modo isolato, provocando ulcerazioni della mucosa orale estremamente dolenti, risultando profonde e crateriformi, spesso circondate da un orletto marginale sollevato ma non indurito alla palpazione.

Fra le manifestazioni collaterali che tali afte possono provocare, figurano l’edema circostante quasi sempre presente, la linfoadenite regionale, ed eventualmente la febbre. Nel caso in cui tale manifestazione colpisca l‘orofaringe, il paziente lamenta disturbi funzionali alla deglutizione, sino al trisma. A causa della profonda necrosi tessutale indotta, la guarigione necessita di parecchio tempo, che può raggiungere le 8 settimane, poiché spesso possono residuare recessioni cicatriziali o difetti tissutali estesi.
La diagnosi differenziale dell’afta major deve considerare le manifestazioni intraorali delle dermatosi vescicolo-bollose che lasciano rapidamente il posto a lesioni secondarie come erosioni o ulcere. Dato che le profonde ulcere tipiche delle afte major possono talvolta essere accompagnate da una notevole sclerosi dei tessuti capace di persistere per settimane, in simili casi è sempre importante considerare la possibilità di un’ulcera carcinomatosa.
Tra le patologie considerate aftose vi sono poi le cosiddette afte di Bednar, che non sono altro che ferite con una sovrapposizione infiammatoria infettiva determinate nei lattanti da un’igiene orale meccanica inadeguata.
Vi è infine una patologia sistemica grave, il morbo di Beçhet, nella quale le afte costituiscono solo una delle manifestazioni parziali di un complesso di sintomi coinvolgenti diversi organi ed apparati. Si tratta infatti di una condizione idiopatica (vasculite sistemica) caratterizzata da una stomatite aftosa ricorrente, spesso con ulcere genitali e lesioni oculari (triade sintomatica).
Da un punto di vista terapeutico, ancora oggi non esistono presìdi in grado di ostacolare la tendenza alla recidiva delle afte ricorrenti. La terapia puramente sintomatica si prefigge lo scopo di alleviare il dolore e di abbreviare il decorso dei singoli attacchi aftosi. A seconda della gravità, fino ad ora la stomatite aftosa è stata trattata per via sistemica mediante cortisonici, immunomodulatori, antivirali o complessi polivitaminici, o per via locale mediante cortisonici locali associati all’orabase, caustici, antidolorifici, antibatterici per uso topico, laser a CO2. Nella nostra esperienza clinica abbiamo constatato che si ottengono buoni risultati prescrivendo l’uso di un cortisonico topico (Triamcinolone 0,1% in orabase) che il paziente applica sulle lesioni aftosiche più volte al giorno, evitando almeno per un’ora e mezza successivamente all’applicazione del prodotto di assumere bevande o alimenti.
Ulcerazioni da infezione di Herpes Simplex Virus
Le lesioni determinate dall’infezione virale da Herpes Simplex prediligono le mucose cheratinizzate. In mancanza di altri segni clinici questo è un importante criterio di differenziazione rispetto le lesioni aftosiche che, al contrario, hanno una prevalente localizzazione a livello delle mucose non cheratinizzate (20) (53).
L’infezione virale da Herpes Simplex è solitamente ricorrente per la caratteristica del virus di rimanere localizzato all’interno delle cellule infettate: questo determina una scarsissima o assente reazione anticorpale che impedisce lo sviluppo di un’immunità specifica (16). Dopo il primo contatto virale l’Herpes risale gli assoni sensitivi del nervo colpito, distribuendosi quindi all’area interessata. Nella sua riattivazione il virus produce un’infezione ricorrente stabilendo uno stato di latenza a livello delle cellule ganglionari che innervano la zona mucosa interessata (19) (31).
Gengivostomatite erpetica primaria
Nella forma di infezione primaria erpetica orale, le lesioni sono di solito confinate alla gengiva aderente e al palato duro. Quasi sempre esse sono accompagnate da febbre, artralgie, cefalea e linfoadenopatia cervicale. La durata media dell’infezione va da 7 a 10 giorni, dopodichè il virus si rifugia nei gangli nervosi pronto a riattivarsi alla successiva occasione. Circa il 40% dei soggetti colpiti da gengivostomatite erpetica primaria sviluppa in seguito l’infezione secondaria. Questa si manifesterà con la formazione in poche ore di caratteristiche vescicole di dimensioni fra 1 e 3 centimetri che rompendosi formeranno, se ammassate, ulcere di varie dimensioni che saranno solo il risultato di una confluenza vescicolare, e non la manifestazione primaria dell’infezione (46) (58).
Un’altra importante caratteristica clinica risiede nella ripetitività locale della reinfezione virale. Infatti, l’HSV ricorre sempre nella stessa sede ad ogni sua nuova manifestazione. Nella comparsa dell’infezione secondaria da HSV, il corteo sintomatologico descritto nell’infezione primaria può essere totalmente assente, mentre sempre presente è il formicolio caratteristico del periodo prodromico (47).
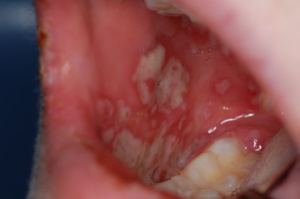
La localizzazione dell’HSV al labbro costituisce nella pratica clinica odontostomatologica la manifestazione più frequente dell’infezione (19) (31).
La sua comparsa si annuncia con prurito localizzato nell’area interessata, la quale dapprima diventa eritematosa, successivamente compaiono una o più vescicole contenenti liquido chiaro, destinate ad aprirsi formando un’escara che non darà però origine a fenomeni di tipo cicatriziale.
Istologicamente si assiste a degenerazione balloniforme delle cellule colpite (effetto citopatico) dopo lo scoppio delle vescicole intraepiteliali, con comparsa di cellule giganti multinucleate ed eosinofile. Spesso l’HSV entra in relazione con la comparsa di episodi ricorrenti di eritema multiforme (EM).
Nei malati sieropositivi e affetti da AIDS conclamata l’infezione può essere estremamente grave, ed occorre instaurare al più presto un’adeguata terapia di supporto (24) (39) (42) (58).
Attualmente il farmaco di elezione per la cura dell’HSV è l‘Acyclovir, che nelle manifestazioni orali della patologia viene somministrato o attraverso sciacqui tramite lo sciroppo, oppure con l’applicazione locale della crema.
Ulcere Traumatiche
Numerose sono le cause riconducibili all’insorgenza di ulcere traumatiche del cavo orale .
CAUSE LOCALI:
-Bordi dentali acuminati;
-Protesi incongrue o reazione ai metalli protesici;
-Corpi estranei acuminati;
-Automutilazioni (epilessia, Sindrome di Down, disturbi psichici, chek biting);
-Materiali dentali;
-Fellatio.
-Rulli di cotone;
-Spazzolino da denti;
CAUSE CHIMICO – FISICHE:
– Farmaci: diidroergotamina – indometacina – methotrexate – azatioprina – acido acetilsalicilico
– Agenti chimici: fenolo –eugenolo –– alcool – resine acriliche – ipoclorito di sodio – paraformaldeide- radioterapia
NECROSI ISCHEMICA (CEFALEA VASOMOTORIA DI HORTON).
CAUSE ASPECIFICHE.
Per definizione l’ulcera vera e propria è tale quando la soluzione di continuità tessutale supera il connettivo e può coinvolgere la sottomucosa, il tessuto muscolare ed arrivare fino al periostio.
Per la valutazione clinica delle ulcere sono importanti alcuni parametri quali: il numero, la forma, la profondità, la qualità dei margini e del fondo, la natura della mucosa circostante, la presenza di sanguinamento spontaneo o provocato (4) (7) (8) (12) (36) (37). Associato all’esame visivo va eseguito un esame palpatorio per escludere la presenza di linfoadenopatie, per verificare la consistenza della lesione e per determinarne la mobilità (5) (6).
Le ulcere traumatiche sono le ulcere di più frequente riscontro nel cavo orale. Possono coinvolgere qualsiasi zona della bocca e spesso sono fonte di non poca preoccupazione da parte del paziente.
Il tempo di comparsa delle ulcere traumatiche è generalmente legato alla modalità della loro insorgenza. Solitamente l’aspetto clinico è caratterizzato dalla presenza di una lesione che può variare da pochi millimetri di diametro a diversi centimetri, a seconda del tipo di trauma ed a seconda o meno della sovrapposizione di infezioni secondarie che aggravano il quadro sintomatologico.

Anche la loro forma è varia e la presenza di un colore rosso vivo o bianco giallastro, di bordi eritematosi o ipercheratosici leggermente rilevati, la sovrapposizione di materiale fibrinoso e necrotico, sono caratteristiche pressoché costanti. L’ulcera traumatica è generalmente dolente rispetto alla sede soprattutto all’inizio della localizzazione e, a seconda delle dimensioni, la sua durata varia da 5 a 10 giorni, guarendo poi spontaneamente senza dar luogo a cicatrici (45) (53).
Ulcere da farmaci e da agenti chimico-fisici
Questo tipo di ulcere è provocato dall’incongruo utilizzo di sostanze chimiche, da reazioni di tipo reattivo farmacologiche, oppure esse possono risultare la conseguenza di terapie radianti. Le ulcere provocate dall’azione di agenti chimici usati nella pratica odontoiatrica hanno generalmente le stesse caratteristiche di quelle esaminate in precedenza, pur avendo una genesi diversa; sono solitamente circoscritte, e tendono a guarire spontaneamente nel giro di 7/8 giorni.
Le sostanze più comuni capaci di provocare ulcere orali sono illustrate nelle cause precedentemente elencate.

Ulcere da cause aspecifiche
Si tratta di ulcere che non hanno una causa definita e si trovano spesso associate a condizioni patologiche che coinvolgono anche il cavo orale. E’ il caso per esempio dei pazienti affetti da istiocitosi idiopatica, che possono sviluppare nel corso della malattia ulcere gengivali.
Tubercolosi
Anche nelle aree geografiche in cui la malattia tubercolare è endemica, la tubercolosi delle mucose orali e/o genitali e della cute è una lesione di osservazione piuttosto rara. Tuttavia, per lo stomatologo risulta comunque molto importante includere nella diagnosi delle ulcerazioni croniche della mucosa orale anche la TBC, visto che in questi ultimi anni si sta registrando una nuova recrudescenza di tale patologia specie nei pazienti HIV positivi, con una previsione per il 2000 di 20 milioni di casi di TBC solo nei paesi sottosviluppati (24) (42).
In base alla sede di comparsa, le lesioni tubercolari orali vengono distinte in quattro categorie:
- a) TBC dell’apice dei denti;
- b) TBC delle ossa mascellari;
- c) TBC della mucosa orale;
- d) TBC della lingua.
La disseminazione di un focolaio polmonare primitivo può determinare la comparsa di lesioni della mucosa orale, che ne risultano quindi molto spesso la conseguenza (40).
I meccanismi patogenetici che alla base dell’interessamento orale da TBC non sono stati ancora completamente chiariti. Sembra che le lesioni orali possano essere la conseguenza di un’inoculazione diretta nelle mucose stesse di bacilli contenuti nelle secrezioni bronchiali emesse mediante lo sputo: la presenza di microabrasioni della superficie mucosa faciliterebbe tale penetrazione. La disseminazione alle mucose orali del Micobatterio Tubercolare attraverso la via ematogena rappresenterebbe un’altra possibilità.
Le lesioni orali da TBC sono quasi sempre rappresentate da ulcerazioni singole o multiple che colpiscono più frequentemente aree mucose sottoposte a trauma (35). La localizzazione linguale è sicuramente la più frequente, seguita dal palato, le labbra, la mucosa vestibolare e la gengiva. Le ulcerazioni sono quasi sempre dolenti, a contorni mal definiti e talvolta di aspetto vegetante. Tali lesioni vengono facilmente considerate ulcere traumatiche o carcinomi squamocellulari.
La TBC può anche colpire le ossa mascellari. In questi casi, il risultato della disseminazione per via ematica è la conseguente localizzazione a livello periapicale. Nei casi di disseminazione ematogena si possono osservare delle forme di osteomielite tubercolare a prognosi molto severa.
La linfoadenopatia loco-regionale generalmente accompagna le lesioni orali. La tubercolosi dei linfonodi cervicali può portare alla scrofula con rottura della cute sovrastante i linfonodi affetti e formazione di fistole multiple. In letteratura figurano anche casi di tubercolosi primaria del cavo orale, ma sono estremamente rari (28).
All’esame istopatologico, le lesioni tubercolari presentano il caratteristico aspetto dei granulomi epitelioidi, con presenza di cellule di Langhans, linfociti e necrosi caseosa, peraltro di non continuo riscontro.
La diagnosi di TBC nell’area testa-collo può essere estremamente complicata, proprio a causa degli aspetti clinici talvolta molto atipici.
Nella diagnosi differenziale della TBC orale vanno incluse la sifilide, le infezioni funginee, l’actinomicosi, le ulcere traumatiche, le afte major e il carcinoma squamocellulare. La diagnosi definitiva deve essere sempre confermata dalla dimostrazione della presenza nelle lesioni del Micobatterio Tubercolare, mediante colorazioni specifiche (Ziehl-Neelsen) e dall’esame colturale.
La terapia della TBC orale è in stretta relazione con il trattamento della forma polmonare primitiva. I farmaci di prima scelta sono rappresentati dall’isoniazide, dalla rifampicina e dall’etambutolo, somministrati per via parenterale.
Lichen erosivo
Il Lichen Planus occupa un importante ruolo nella pratica della Medicina e della Patologia Orale. Esso è una patologia muco-cutanea a carattere infiammatorio cronico, descritta per la prima volta da Wilson nel 1869, ed in seguito caratterizzata istologicamente da Dubruill nel 1906 (22).
Nonostante i numerosi studi condotti, l’eziologia resta sconosciuta, anche se numerose ipotesi sono state fatte a tale riguardo. Fra di loro, l’ipotesi autoimmunitaria risulta quella maggiormente accreditata (1)(7)(8)(17)(27)(44).
Il quadro istologico è caratterizzato dalla presenza di ipercheratosi, acantosi dell’epitelio e da una liquefazione dello strato epiteliale basale sovrastato da un infiltrato linfocitario “a banda”.
Clinicamente il lichen planus orale può manifestarsi in varie forme (Tabella III), la più comune delle quali è la forma reticolare, caratterizzata dala presenza delle strie di Wickham (striature cheratosiche di colore bianco leggermente rilevate).
Le altre forme sono la variante papulare, quella definita “a placche”, la forma atrofico-ulcerativa, la forma ulcerativa e quella bollosa.
La prevalenza della componente bianca o rossa in sede delle lesioni consente di distinguere i diversi quadri lichenoidi anche da un punto di vista sintomatologico (7) (8). Generalmente le forme definite bianche non arrecano alcun disturbo al paziente se non, a volte, sensazione di prurito, e nella grande maggioranza dei casi vengono scoperte durante normali visite odontoiatriche. Viceversa, provocano gravi disagi le cosiddette forme rosse, in quanto le mucose sono in questi casi più sensibili agli stimoli esterni a causa della perdita degli strati superficiali (25). Alcune di queste forme hanno la propensione a sviluppare una situazione di tipo neoplastico-maligna (29).
Epidemiologicamente, il lichen planus orale è una patologia relativamente frequente e spesso misconosciuta, che colpisce dall’1 al 2 % della popolazione (Axell), con la forma reticolare che si manifesta più frequentemente (73,3% dei casi), seguita dalla forma a placche (13,2% dei casi), dalla forma papulare (9,5% dei casi), dalla forma ulcerosa (7,8%), da quella atrofica (2,7% dei casi), ed infine dalla forma bollosa, meno frequente (0,7%). La localizzazione più frequente è rappresentata dalla mucosa geniena, colpita nel 43% dei casi, seguita dalla superficie dorsale della lingua (29%), dalla gengiva (13%), dalla commissura labiale (10%), dalle labbra (4%) e dal palato (1%). Oltre alla mucosa orale può colpire anche la cute, infatti oltre il 50% dei pazienti con lesioni cutanee presentano il lichen anche a livello del cavo orale, mentre viceversa nei pazienti con localizzazione primaria del lichen in sede orale solo il 25% avrà uno sviluppo anche a livello cutaneo. Oltre alle lesioni orali possono essere colpiti i genitali, cosicchè la situazione clinica che ne deriva è conosciuta con il termine di sindrome vulvo-vagino-gengivale. Dagli studi pubblicati sembra colpire con maggior prevalenza il sesso femminile rispetto a quello maschile; l’età media colpita nei due sessi è praticamente sovrapponibile, oscillando tra i 30 e i 70 anni.
Tabella II – Aspetti clinici del lichen orale.
|
LESIONI CHERATOSICHE O QUIESCENTI |
FORME CLINICHE EVOLUTIVE |
|
Reticolare |
Vescicolo-bollosa o lichen pemfigoide |
|
Anulare |
Atrofica |
|
“A placca” |
Ulcerativa o erosiva |
Forma erosiva

Può essere l’evoluzione della forma atrofica a causa della distruzione dell’epitelio. Si possono distinguere una forma minore, con erosioni poco profonde, da non confondere con alcune lesioni causate dal pemfigo e dal pemfigoide nelle quali è avvenuta la perdita dell’epitelio della bolla, ed una forma maggiore, più rara, con estese ulcerazioni capaci di interessare in profondità la regione colpita (solitamente la lingua). Il fondo della lesione è necrotico, ed il dolore è urente.
In tale forma, la diagnosi differenziale è da porsi con il carcinoma, che può essere una complicanza stessa della lesione o addirittura già coesistere (52) (56). In tali casi risulta fondamentale l’esecuzione di una accertamento istologico (23)(26)(29).
Forma bollosa
Si tratta di una forma molto rara, nella quale la diagnosi differenziale è da porsi con il pemfigo e con il pemfigoide.
Da un punto di vista sintomatologico, è possibile affermare che la sintomatologia può variare da una completa assenza di sintomi (di solito caratteristica delle forme reticolari o a placca), ad una sintomatologia imponente, con dolore urente e continuo, che si esacerba con l’introduzione di cibo acido, piccante, o con alcool, sino a rendere talvolta difficoltosa l’alimentazione del paziente; tali sintomi solitamente si associano alle forme erosive e bollose, essendo evidentemente in relazione con il grado di disepitelizzazione che accompagna le lesioni. In queste forme il paziente riferisce spesso di aver perduto la percezione del gusto.
In circa la metà dei casi, l’aspetto clinico è sufficiente per poter formulare la diagnosi. Gli accertamenti istologici, indispensabili in tutte le forme cliniche di lichen, sono risolutivi nei casi di lichen bolloso, atrofico ed erosivo in cui è necessario escludere la presenza di aree eritroplasiche o displasiche. A tale scopo può risultare d’aiuto l’impiego della colorazione con il blu di toluidina per stabilire l’area in cui eseguire il prelievo. Nei casi in cui anche l’esame istologico non dia un risultato sicuro, è stato proposto l’impiego di esami immunoistochimici ed ultrastrutturali.
I quadri istologici che caratterizzano il lichen planus orale ricalcano da vicino la morfologia del lichen a livello cutaneo, ed essi sono:
– ipercheratosi o paracheratosi;
– acantosi;
– ispessimento dello strato granulare;
– degenerazione vacuolare dello strato basale;
– presenza di un infiltrato linfocitario “a banda”;
– epitelio con aspetto delle creste “a dente di sega”.
Essendo il lichen planus una patologia muco-cutanea di tipo cronico, osservare una guarigione completa è estremamente raro. Inoltre, le recidive sono frequenti e difficili da prevedere. A tutt’oggi non esiste una terapia definitiva per il lichen planus orale: l’unico trattamento possibile è di tipo sintomatico, atto cioè ad alleviare il dolore o il fastidio causati da tale malattia.
Il farmaco più utilizzato nel trattamento del lichen planus orale è il cortisone, somministrato a seconda della gravità o per via locale (Triamcinolone 0,1% in orabase), oppure per via sistemica (Urbason cp.). Discreti successi si sono ottenuti anche con l’impiego di ciclosporina, sia per sciacqui orali (Ciclosporina al 4%), che per via sistemica. (3)(22)(41)
Eritroplasia o Eritroplachia
Il significato del termine eritroplasia è quello di “lesione rossa”, riferendosi ad una patologia a confini più o meno definiti, di colorito rosso acceso (in ogni caso sempre più rosso rispetto la mucosa circostante) e superficie vellutata (54)(55). In base a criteri istopatologici e clinico-prognostici, tale lesione può essere assimilata all’eritroplasia di Queirat ed al morbo di Bowen (7)(8). Il morbo di Bowen ha un’evoluzione molto lenta, la sede elettiva di comparsa delle lesioni è rappresentata dalla cute del tronco ma può colpire anche le mucose. La tipica lesione bowenoide è rappresentata da una placca eritematosa appiattita a margini ben definiti e superficialmente desquamata (talvolta verruciforme o crostosa). La sua ulcerazione è il segno prognostico indicativo di crescita invasiva. Il quadro istologico è dominato dall’acantosi con presenza di cellule squamose atipiche (cheratinizzazione prematura, forme gigantocellulari, figure mitotiche frequenti, nuclei grandi e ipercromatici).

L’ eritroplasia di Queirat, pur avendo un’istopatologia di tipo bowenoide, ha potenzialità invasive superiori a quelle del morbo di Bowen: si tratta in realtà di un vero e proprio carcinoma in situ della mucosa del glande o del prepuzio, e quindi all’ istopatologia bowenoide mancheranno lo strato corneo e l’ipercheratosi paracheratosica.
Il quadro istopatologico dell’eritroplasia orale mostra alterazioni epiteliali di grado variabile sino all’ epitelioma in situ, consistenti in acantosi, ipercheratosi paracheratosica, atipie nucleari, frequenti mitosi, infiltrati linfoplasmacellulari a livello del corion e conseguente dilatazione del plesso papillare. Tale lesione rientra pertanto tra gli stati cancerizzabili del cavo orale obbligati (potenzialità di degenerazione invasiva fino al 100 %), potendosi presentare macroscopicamente in tre forme caratteristiche: forma verrucosa o papillomatosa, forma ipercheratosica, forma leucoplastica (36)(37).
1) forma verrucosa o papillomatosa: il quadro è dominato da modesti rilievi mucosi di dura consistenza e colorito bianco-grigiastro;
2) forma ipercheratosica: di colore bruno ed a superficie mammellonata;
3) forma leucoplasica: poco rilevata, a contorni ben definiti, dura di consistenza e di colorito bianco-grigiastro.
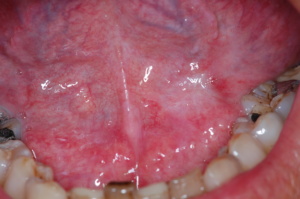
Da un punto di vista clinico la lesione rappresenta un reperto occasionale e nella maggioranza dei casi è asintomatica. All’esame obiettivo si rendono evidenti singole o molteplici chiazze rotondeggianti a volte ben delimitate, piane o poco rilevate e su mucosa sana, a superficie lucida e colorito rosso acceso. Molto spesso le lesioni appaiono circondate da un alone ipercheratosico. Nel loro contesto vi sono spesso aree di displasia e/o di carcinoma in situ, ma i repentini cambiamenti macroscopici delle lesioni sono imputabili prevalentemente alla variazione dell’infiltrato flogistico subepiteliale (linfociti e plasmacellule): ciò determina la modificazione del loro aspetto anche da un giorno all’altro, con un alternarsi di aumento e di riduzione volumetrico (48).
Anche se il decorso è lento, l’evoluzione dell’eritroplachia prevede l’abrasione e la manifesta cancerizzazione con precoce interessamento linfoghiandolare (48).
La diagnosi differenziale va posta con le altre lesioni rosse, quali ad esempio quelle tubercolari e luetiche, e viene definitivamente chiarita solo con l’esame bioptico e la successiva processazione istologica (45)(51).
Carcinomi del cavo orale
Il lichen erosivo e l’eritroplachia, in precedenza descritti, appartengono a quadri clinici che possono essere definiti lesioni precancerose del cavo orale (3)(36)(55).
Le lesioni precancerose del cavo orale si possono a loro volta definire come patologie proliferative cellulari focali maligne in seno all’epitelio da cui originano: istologicamente le si identifica come displasie epiteliali, considerabili come veri carcinomi a tutti gli effetti, salvo per il mancato superamento della membrana basale (15). E’ questo il motivo per cui oggi si sente parlare di Oral Intraepithelial Neoplasia (“OIN”: neoplasia intraepiteliale del cavo orale). La neoplasia intraepiteliale del cavo orale è stata suddivisa in tre gradi isto-citologici, a seconda delle atipie cellulari e dell’estensione all’ interno della lamina epiteliale (57):
-Grado 1: quando interessa il terzo inferiore dell’epitelio (displasia lieve);
-Grado 2: quando l’epitelio è coinvolto dalla parte inferiore per uno spessore maggiore di 1/2 e minore di 2/3 (displasia moderata);
-Grado 3: quando l’intera lamina epiteliale è coinvolta, dal basso verso la superficie libera, dalla lesione atipica (displasia grave o carcinoma in situ).
L’ irrequietezza proliferativa ed il grande stato di allarme e di mobilitazione della neoplasia intraepiteliale del cavo orale realizzano, dopo un periodo di quiescenza variabile da 1 a 30 anni, un avanzamento del tutto probabile, al di la di quella barriera anatomica rappresentata dalla membrana basale (43).
Si realizza così l’inversione della polarità di crescita atipica, con l’avvio di quei fenomeni di aggressività e di invasione dell’interland, dapprima iniziali (carcinoma microspray). Poi più o meno ampiamente infiltranti in profondità, che conducono alla comparsa del carcinoma conclamato, ed in fine a distanza, in altri organi.

Sebbene il cavo orale sia facilmente accessibile all’ esame clinico e il paziente effettui periodici controlli dal dentista, la diagnosi di carcinoma è spesso tardiva (160 giorni di media in Italia, secondo Squadrelli-Saraceno).
I tumori maligni del cavo orale rappresentano il 3-5% dei carcinomi in generale (4)(5)(6). Il carcinoma a cellule squamose è il più frequente costituendo circa il 90% di tutte le neoplasie maligne del cavo orale. Sebbene siano stati invocati numerosi fattori predisponenti, la causa è sconosciuta (11)(21)(30)(32)(33)(34).
E’ stato valutato che circa il 50% dei pazienti con carcinoma orale presenta metastasi locali o a distanza al momento della diagnosi.
Nell’ ambito delle neoplasie maligne del cavo orale, considerando gli aspetti istologici, il carcinoma del cavo orale può presentarsi sotto diverse forme:
– carcinoma spinocellulare
– carcinoma basocellulare
– carcinoma verrucoso
– carcinoma polimorfocellulare
– adenocarcinoma
– carcinoma a cellule fusiformi
Vengono presi in esame sommariamente i due tipi più frequenti di carcinomi orali che rappresentano più del 90% del totale dei tumori del nostro distretto.
Carcinoma spinocellulare
Come già accennato, rispetto alle altre forme carcinomatose interessanti i tessuti molli del cavo orale, lo spinocellulare è quello che si presenta con maggiore frequenza. E’ più frequente nell’ uomo (rapporto maschio-femmine di 2:1) di età superiore ai 40 anni.
E’ caratterizzato da elementi cellulari epiteliali maligni, irregolarmente distribuiti a forma di dischi, trabecole o cordoni, che infiltrano i sottostanti tessuti. Reperto tipico è rappresentato dalla presenza delle cosidette “perle cornee“, evidenti al centro dei cordoni e costituite da vortici di cellule discheratosiche con nuclei picnotici conglomerati.
L’ aspetto macroscopico è di solito ulcerativo ed infiltrante, sanguinante, dolente se localizzato al confine della radice linguale o sul margine della stessa.

Carcinoma verrucoso
Talvolta classificato come variante clinica del carcinoma spinocellulare, il carcinoma verrucoso è istologicamente individuabile grazie alla presenza di grandi colate cellulari nettamente cheratinizzate e raramente in mitosi. Pur essendo considerato a basso grado di malignità ed a lenta evoluzione, tende a distruggere i tessuti sottostanti erodendoli piuttosto che infiltrandoli.
Macroscopicamente ha uno sviluppo di tipo esofitico, di colorito rosso-rosaceo, simil-verrucoso.

Discussione
Nella pratica clinica l’Odontoiatra e il Medico Specialista si trovano spesso di fronte a quadri di ulcerazioni orali eterogenei. Nonostante la bocca sia facilmente esaminabile oltre ad una non corretta diagnosi circa la natura delle lesioni, si verifica spesso inspiegabilmente un notevole ritardo diagnostico tutto a danno del paziente. Se diagnosticare una lesione erpetica per una stomatite aftosa ricorrente non aggrava più di tanto il quadro clinico, ben diverso è non soffermarsi a considerare grave un’ulcerazione con possibili caratteristiche di malignità. Ancor oggi il ritardo diagnostico di certe patologie supera i 100 giorni, quando già 14, secondo il WHO (World Healt Organisation), sono sufficienti per guardare con sospetto un’ulcerazione orale.
Il miglior atteggiamento resta quindi quello di indirizzare tempestivamente al Patologo Orale, quando la propria pratica clinica non lo consente, quei casi di dubbia interpretazione o di particolare impegno diagnostico, educendo il paziente nella misura più ampia possibile affinchè egli abbia la consapevolezza del problema occorsogli. Il più efficace comportamento clinico resta la prevenzione senza la quale si perdono le battaglie più impegnative sia per ciò che riguarda le patologie neoplastiche che le malattie sistemiche, la cui prima manifestazione avviene spesso nel cavo orale.
Prima della terapia bisogna porre una diagnosi, perlomeno presunta e plausibile, e ciò deve avvenire con tutti i mezzi a nostra disposizione: visita, esami diagnostici (es. citologico tramite scraping o agoaspirato; esame istologico tramite il prelievo bioptico), esami strumentali e soprattutto, nel caso in cui non si sappia come e cosa fare, con una buona dose di umiltà, consultare il collega patologo orale, poiché chiedere a chi ha più esperienza specifica è un grande segno di intelligenza critica e non un’ammissione di incompetenza intesa nella sua peggiore accezione.
Bibliografia
- Ayala, F., Matarasso, S., De Rosa, S., Bordone, F., Vaia, E., Balato, N.: Studio sulla relazione tra il lichen ruber planus orale, epatopatie ed ipersensibilità a componenti di restauri dentari. Minerva Stomatol, 39 (2): 129-132, 1990.
- Barrelier, P., Louis, M.Y., Babin, E.: The use of cryotherapy in oral pathology. Our experience in 36 cases. Rev Stomatol Chir Maxillofac, 93 (5): 345-348, 1992.
- Botticelli, A.R., Ficarra, G., Zaffe, D.: Istopatologia del cavo orale. Atti Congressuali Cenacolo Odontostomatologico Milanese. Botticelli, A.R.: Lesioni precancerose della mucosa orale 1-9. Milano, 1996
- Boyle, P., Macfarlane, G.J., McGinn, R., Zheng, T., La Vecchia, C., Maisonneuve, P., Scully, C.: International epidemiology of Head and Neck cancer. In: de Vries, N., Gluckman, J.L. (eds.). Multiple Primary Tumors in the Head and Neck, p. 81-138.Thieme Verlag, New York, 1990.
- Bussi, M.: Workshop Internazionale: Le recidive loco-regionali del distretto cervico-facciale. Bollt, IV (2) : 16, 1992.
- Calpicchio, A., Iofrida, R.V., Manieri, A., Cianfriglia, F.: Incremento dei tumori nella cavità orale. DM, 9: 59-71, 1993.
- Chiarini, L., Bertoldi, C., Tanza, D., Cappelletto, M.: Stati cancerizzabili del cavo orale. Considerazioni generali. Rassegna critica della letteratura. Nota I. Minerva Stomatol, Vol. 43 N. 7-8: 309-318, 1994.
- Chiarini, L., Bertoldi, C., Tanza, D., Cappelletto, M.: Stati cancerizzabili del cavo orale. Considerazioni generali. Rassegna critica della letteratura. Nota II. Minerva Stomatol, Vol. 43 N. 7-8: 319-333, 1994.
- Chiesa, F., Sala, L., Costa, L., Moglia, D., Mauri, M.: Excission of oral leukoplakia by CO2 laser on an out-patient basis: a useful procedure for prevention and early detection of oral carcinomas. Tumori, 72: 307-318, 1986.
- Chiesa, F., Tradati, N., Costa, L., Grandi, M.: Le neoplasie del cavo orale: problemi diagnostici e implicazioni medico-legali. Atti Congressuali Cenacolo Odontostomatologico Milanese. Istituto Nazionale Tumori. Milano, 1996.
- Chiesa, F., Tradati, N., Marazza, M., Rossi, N., Boracchi, P., Mariani, L., Clerici, M., Formelli, F., Barzan, L., Carrassi, A., Pastorini, A., Camerini, T., Giardini, R., Zurrida, S., Minn, F.L., Costa, A., De Palo, G., Veronesi, U.: Prevention of local relapsed and new localisations of oral leukoplakias with the synthetic retinoid fenretinide (4-HPR). Preliminary results. Oral Oncol, Eur J Cancer, Vol. 28 B N. 2: 97-102, 1992.
- Chiesa, F., Tradati, N.: Le precancerosi del distretto cervico facciale. Bollt, IV (2) : 6-8, 1992.
- Colella, G., Gritti, P., De Luca, F., De Vito, M.: Sugli aspetti psicopatologici del lichen planus orale (LPO). Minerva Stomatol, Vol. 42 N. 6: 265-270, 1993.
- Coraini, C., Crippa, R.: Lesioni preneoplastiche e neoplastiche del cavo orale: studio dell’attività proliferativa. Il Dentista Moderno n. 5: 135-147, 1998.
- Cox, M., Maitland, N., Scully, C.: Human Herpes Simplex-1 and Papillomavirus tipe-16 homologous DNA sequences in normal, potentially malignant and malignant oral mucosa. Oral Oncol, Eur J Cancer, Vol. 29 B N. 3: 215-219, 1993.
- Dante, G., Fusco, A., Coraggio, F.: Il lichen planus della mucosa orale: aspetti eziopatogenetici. Minerva Stomatol, 38 (7): 801-806, 1989.
- Dante, G., Fusco, A., Vaia, E.: Lichen planus orale e materiali dentari: rapporti eziopatogenetici e clinici. Minerva Stomatol, 38 (7): 807-810, 1989.
- Das, C.M., Murrah, V.A., Zhang, S., Wong, G., Gilchrist, E.P., Shillitoe, E.J.: The effect on cell phenotype of the mutagenic peptide of Herpes Simplex Virus type-1. Oral Oncol, Eur J Cancer, Vol. 31 B N. 4: 267-274, 1995.
- De Michelis, B., Modica, R., Re, G.: Trattato di Clinica Odontostomatologica. III edizione. Minerva Medica. Torino, 1992.
- de Vries, N., van Zandwijk, N., Pastorino, U.: Chemoprevention in the management of oral cancer: EUROSCAN and other studies. Oral Oncol, Eur J Cancer, Vol. 28 B N. 2: 153-157, 1992.
- Debreuill, W.: Histologie du Lichen Plan des muqueses. Ann Dermatol, 7: 123-129, 1906.
- Epstein, J.B., Scully, C., Spinelli, J.: Toluidine blue and Lugol’s iodine application in the assessment of oral malignant disease and lesions at risk of malignancy. J Oral Pathol Med, 21: 160-163, 1992.
- Ficarra, G., Silverman, S. Jr., Lozada-Nur, F., Greespan, D., Hansen, L.S., Green, T.L.: Sindrome da immunodeficienza acquisita (AIDS): lesioni del cavo orale. Mondo Odontost, 3: 17-26, 1986.
- Galliano, D., Cardesi, E., Gandolfo, S., Gatto, V.: Lesioni cheratosiche del cavo orale. Note di diagnosi differenziale istopatologica tra leucoplachia, lichen planus, lupus eritematoso. Minerva Stomatol, 38 (IV): 481-487, 1989.
- Gandolfo, S., Carbone, M., Carrozzo, M., Scamuzzi, S.: Tecniche bioptiche in oncologia orale: biopsia incisionale o escissionale? Revisione critica della letteratura e contributo personale. Minerva Stomatol, Vol. 42 N. 3: 69-75, 1993.
- Gandolfo, S., Carbone, M., Zulian, P., Broccoletti, R., Carrozzo, M.: Lichen-planus orale e patologia epatica. Correlazioni clinico-statistiche tra manifestazioni orali e danno epatico. Parte II. Minerva Stomatol, 41 (5): 209-213, 1992.
- Hashimoto, Y., Tanioka, H.: Primary tubercolosis of the tongue: report of a case. J Oral Maxillofac Surg, 47: 744-746, 1989.
- Holmstrup, P., Pindborg, J.J.: Malignant development of Lichen Planus affected oral mucosa. J Oral Pathol, 17: 219-225, 1988.
- La Vecchia, C., Franceschi, S., Levi, F., Lucchini, F., Negri, E.: Diet and Human Oral Carcinoma in Europe. Oral Oncol, Eur J Cancer, Vol. 29 B N. 1: 17-22, 1993.
- Larsson, P.A., Edstrom, S., Westin, T., Nordkrist, A., Hirsh, J.M., Vahlne, A.: Reactivity against HSV in patients with head and neck cancer. Int J Cancer, 49: 14-18, 1991.
- Ma, R., Epstein, J.B., Emerton, S., Hay, J.H.: A preliminary investigation between dental restorations and carcinoma of the tongue. Oral Oncol, Eur J Cancer, Vol. 31 B N. 4 : 232-234, 1995.
- Macfarlane, G.J., Boffetta, P., Boyle, P., Zheng, T., Marshall, J.R., Niu, S., Brasure, J., Merletti, F.: Alcool, tobacco, diet and the risk of oral cancer: a pooled analysis of three case-control studies. Oral Oncol, Eur J Cancer, Vol. 31 B N. 3: 181-187, 1995.
- Mashberg, A., Meyers, H.: Anatomical site and size of 222 early asymptomatic oral squamous cell carcinomas. Cancer, 37: 2149-2154, 1976.
- McAndrew, P.G., Adekyle, E.O.: Miliary tubercolosis presenting with multifocal oral lesions. Br Med J, 1: 1320, 1976.
- Molinari, R., Cantù, G.: Le precancerosi orali. Protocollo di diagnosi e terapia. In : Segreteria delle Forze Operative Nazionali del Progetto Finalizzato dal C.N.R. “Oncologia” (Ediz.) : Definizione e storia naturale, p. 13-27. Milano, 1990.
- Pindborg, J.J. Lesions of the oral mucosa to be considered premalignant and their epidemiology. In: Mackenzie, I.C., Dobelsteen, E., Squier, C.A. eds. University of Yowa Press: 2-14. Yowa City, 1980.
- Pindborg, J.J., Van der Waal, I.: Malattie della lingua. Scienza e Tecnica dentistica edizioni internazionali. Milano, 1987.
- Pindborg, J.J., Williams, D.M.: Aggiornamento della classificazione e dei criteri diagnostici delle lesioni orali nell’ infezione da HIV. Minerva Stomatol, 42 (5): 223-227, 1993.
- Sammartino, G., Battagliese, G.: Il complesso primario del cavo orale. Problema diagnostico. Nota II. Min Stomatol, 35: 1143-1146, 1986.
- Sardella, A., Abati, S., Carrassi, A.: Valutazione dell’attività proliferativa del lichen planus orale. Minerva Stomatol, 40 (9): 57-61, 1991.
- Schiodt, M., Pindborg, J.J.: AIDS and the oral cavity. Epidemiology and clinical oral manifestation of Human Immunodeficiency Virus infection: a review. Int J Oral Maxillofac Surg, 16: 1-4, 1987.
- Scully, C., Boyle, P., Chiesa, F., Lefebvre, J.L., Macfarlane, G.J., Blot, W.J., Mano Azul, A., De Vries, N.: European School of Oncology advisory report to the European Commission for the Europe against cancer programme: oral carcinogenesis in Europe. Oral Oncol., Eur J Cancer, Vol. 31 B N. 2: 75-85, 1995.
- Scully, C.: Lichen Planus: review and update on pathogenesis. J Oral Pathol, 14: 431-458, 1985.
- Scully, C.: Oral precancer: Preventive and medical approaches to management. Oral Oncol, Eur J Cancer, Vol. 31 B N. 1: 16-26, 1995.
- Scully, C.: Viruses and oral squamous carcinoma. Oral Oncol, Eur J Cancer, Vol. 28 B N. 1: 57-59, 1992.
- Sfacteria, C.: L’infezione da Herpes Virus. DM, 8: 55-85, 1989.
- Shear, M.: Erythroplakia of the mouth. Int Dent J, 22: 460-473, 1972.
- Siervo, S., Coraini, C., Siervo, R.: Il Laser a CO2 per il trattamento dei tessuti molli. Il Dentista Moderno n. 4: 35-42, 1998.
- Silverman, S. Jr., Bhargava, K., Mani, T., Smith, L.W., Maloawalla, A.M.: Malignant transformation and natural history of oral leukoplakia in 57.518 industrial workers of Gujarat, India. Cancer, 38: 1790-1795, 1976.
- Silverman, S., Lozada, F.: A prospective follow-up study of 570 patients with oral lichen planus: persistence, remission, and malignant association. Oral Surg Oral Med Oral Pathol, 60: 30, 1985.
- Strassburg, M., Knolle, G.: Disease of the Oral Mucosa – a Color Atlas. Quintessence Publishing Co., Inc., 1994.
- Toma, S., Rotondi, M., Mangiante, P.E.: Le lesioni precancerose del cavo orale. Bollt, IV (2) : 9-11, 1992.
- Tradati, N., Zurrida, S., Calabrese, L., Costa, L., Marazza, M., Rossi, N., Chiesa, F.: Precancerosi del cavo orale. Criteri diagnostici e orientamenti terapeutici. FM 2: 15-18, 1995.
- Tyldesley, W.R.: Malignant transformation in oral lichen planus. Br Dent J. 153-329, 1982.
- Atlante TNM. Guida illustrata alla classificazione TNM/pTNM dei tumori maligni. Terza Edizione, Seconda Revisione. R. Cortina ed. Milano, 1992.
- Vasudevan, D.M., Shanavas, K.R., Kala, V., Vijayakumar, T., Kumari, T.V.: Association of Herpes group of Virus with oral cancer. In: Varma A.K. ed. Oral Oncol, 113-116, Macmillian Press. New York, 1991.
- WHO Collaborating Center for Oral Precancerous Lesions. Definition of leukoplakia and related lesions: an aid to studies in oral precancer. Oral Surg, 46: 518-539, 1978.











