
Introduzione
Nel cavo orale le patologie gengivali più frequenti sono quelle di tipo mucoso, ma anche quelle che meno spesso sono correttamente diagnosticate. Molte di esse si presentano, infatti, in maniera del tutto simile e risultano morfologicamente difficili da distinguere, anche quando a determinarle sono fattori di varia natura, diversi per eziologia e patogenesi.
In questo articolo cercheremo di evidenziare quali sono i criteri diagnostici più comuni per differenziare i vari tipi di gengiviti e vedremo cosa la letteratura internazionale ci suggerisce in termini di trattamento terapeutico.
Molto spesso il paziente affetto da gengivite sottovaluta il fenomeno e si reca dal farmacista, ancor prima che dallo specialista, per cercare una facile e immediata soluzione terapeutica. Questo aspetto non fa che ritardare, per dilazione farmacologica, quelli che sono i tempi, in alcuni casi molto preziosi, per effettuare una diagnosi precoce delle lesioni del cavo orale (prima fra tutte quella per escludere un carcinoma spinocellulare). Tratteremo quindi le varie forme di gengiviti a partire dalle più semplici, cercando di fornire un quadro semplice, esaustivo e di auspicabile utilizzo nella pratica quotidiana, delle varie forme esistenti.
 Gengivite e Parodontite
Gengivite e Parodontite
Gengivite e parodontite sono due diverse manifestazioni dello stesso processo patologico.
La gengivite è un’infiammazione del solo tessuto gengivale (tabella 1), la parodontite interessa il parodonto profondo, cioè il tessuto di sostegno del den-te, quindi il connettivo e l’osso alveolare di supporto. Tutti gli adulti presentano qualche evidenza di parodontite iniziale, ma la malattia avanzata colpisce solo il 10-15% della popolazione. Fortunatamente la perdita dei denti, come conseguenza della distruzione paro-dontale, è poco frequente prima dei 50 anni. Negli adulti, la maggior parte dei tipi di parodontite è considerata una manifestazione della stessa malattia, ma forme più rare possono colpire anche pazienti più giovani.
Eziologia
Il fattore eziologico primario della gengivite e della malattia parodontale è la placca microbica. La flora batterica normalmente presente nel cavo orale varia da individuo a individuo e, in condizioni di salute, vi è un equilibrio tra i vari ceppi di microrganismi, condizione che impedisce ogni azione distruttiva sui tessuti parodontali. La persistenza della placca comporta una colonizzazione microbica sequenziale della superficie del dente, caratterizzata da un aumento dei batteri anaerobi, dei Gram negativi e delle forme mobili:
- nella gengivite in via di sviluppo predomina il genere Actinomyces ma vi è un sostanziale aumento dei microrganismi anaerobi obbligati e dei Gram negativi;
- nella parodontite predominano bacilli Gram negativi, forme mobili (Campylobacter rectus, Seleno-monas sputigena ecc) e spirochete (Treponema denticola), nonché membri del gruppo “bacteroides neropigmentati”, come Porphyromonas gin-givalis e Prevotella intermedia.
Anche altri fattori possono concorrere allo sviluppo di queste patologie:
- fattori locali come l’anatomia del dente, l’allinea-mento, gli anomali rapporti occlusali, la presenza di restauri interdentali incongrui, possono favorire l’accumulo e la crescita della placca o sfavorirne la ri-mozione;
- il fumo di tabacco agisce secondo un meccani-smo non ancora completamente chiaro, in quanto influenza negativamente la chemiotassi e la fagocitosi dei polimorfonucleati ma non determina diffe-renze nella composizione della placca subgengivale. La vasocostrizione indotta dalla nicotina, inoltre, riduce il sanguinamento gengivale: viene così a mancare un importante “campanello d’allarme” per il paziente;
- alcuni farmaci, come la nifedipina (calcio antagonista), la fenitoina (antiepilettico) e la ciclosporina (immunosoppressivo) possono provocare un au-mento di volume gengivale in circa il 30% dei soggetti sottoposti alla terapia;
- alterazioni ormonali (tipiche dell’età puberale, della gravidanza, delle donne che assumono contraccettivi orali) possono provocare alterazioni vascolari e aumento di volume gengivale;
- fattori nutrizionali, come la carenza di micronutrienti (es. vitamina C), possono favorire l’infiammazione gengivale;
- patologie sistemiche e malattie del sangue possono causare sanguinamento e aumento di volu-me della gengiva, con cambiamento morfologico della sua superficie.
Classificazione delle gengiviti
Gengivite da cause infiammatorie
Secondaria a infiammazione acuta
Un aspetto particolare della patologia parodontale è rappresentato dall’ascesso, termine che indica una raccolta di materiale purulento in una cavità forma-tasi secondariamente a necrosi tessutale nel conte-sto del tessuto parodontale.
Ascesso parodontale secondario a parodontite
L’ascesso parodontale secondario a parodontite, ben distinto dal più comune ascesso periapicale, si sviluppa nei tessuti parodontali a livello della superficie laterale del dente. Nella maggior parte dei casi origina in pazienti con preesistente parodontite in fase avanzata in seguito all’aumento di virulenza dei microrganismi della placca e dei fattori tossici da essi rilasciati o a causa delle ridotte resistenze dell’ospite. Un ruolo primario è svolto dall’ostruzio-ne al drenaggio dell’essudato da una tasca parodontale secondaria a tartaro o coaguli, con estensione del processo suppurativo nei tessuti circostanti.
L’ascesso si presenta come una tumefazione gengivale localizzata con superficie liscia, lucente e arrossata (fig. 1); nella parte più prominente può evidenziarsi una zona di colore giallo-grigiastro, secondaria ad accumulo di materiale purulento. Può anche essere presente un tragitto fistoloso, attorno al cui orifizio si osserva una proliferazione tissutale che determina la formazione di un nodulo rilevato. Il drenaggio può avvenire spontaneamente attraverso l’apertura della tasca o, in caso di lesioni profonde e presenza di ostruzioni, farsi strada lungo la radice e fistolizzare. La fuoriuscita di pus allevia i sintomi acuti (tipicamente dolore pulsante) e la lesione può guarire o cronicizzare con emissione discontinua di pus. L’ascesso cronico può es-sere asintomatico o dar luogo a episodi di dolore sordo; sono frequenti le riesacerbazioni. All’asces-so secondario a parodontite si associano altri dati clinici, quali:
- mobilità dell’elemento o degli elementi dentari corrispondenti;
- elementi dentari sensibili alla percussione e vitali;
- tasca parodontale.
Gli aspetti radiografici sono molto variabili e sono influenzati dall’entità della preesistente distruzione ossea, dallo stadio dell’ascesso e dalla sua localizzazione. La formazione dell’ascesso può essere accompagnata da rapido approfondimento di tasche infraossee ma, nelle fasi precoci, possono non esservi alterazioni radiografiche. Nelle lesioni profonde è possibile osservare una distinta area radiotrasparente in corrispon-denza della faccia laterale della radice.
Ascesso parodontale secondario a trauma
L’ascesso secondario a trauma è più raro e può essere determinato, in assenza di tasche, da lesioni traumatiche di un dente (perforazione laterale della radice in corso di terapia endodontica) o da un corpo estraneo (la setola di uno spazzolino, una spina di animale o di vegetale di origine alimentare) che penetra nel tessuto, crea una soluzione di continuo a livello gengivale e innesca un’infezione del legamento parodontale. A differenza di quanto descritto per l’ascesso secondario a parodontite, consistenza e aspetto della gengiva si presentano frequentemente normali così come, radiologicamente, l’osso alveolare.
Terapia farmacologica
La terapia dell’ascesso parodontale comprende un trattamento d’urgenza, a cui seguirà una terapia eziologica ed eventuale terapia chirurgica della lesione. La terapia d’urgenza varia in relazione alla forma clinica dell’ascesso. Nell’ascesso organizzato drenante e/o fistolizzato si eseguirà un ampliamen-to della via d’evacuazione del materiale purulento, con irrigazione a base di clorexidina allo 0,12%, acqua fisiologica e acqua ossigenata a 12 volumi. Nel caso di ascesso non drenante e non fistolizzato si eseguirà un’incisione per favorire il deflusso del materiale purulento, associata a irrigazione con soluzione a base di clorexidina allo 0,12% o al posizionamento di un gel a base di clorexidina allo 0,2% Nell’ascesso in via d’organizzazione, si attuerà una pulizia radicolare (curettage) associata a irrigazione del sito infetto, se la lesione è accessibile; si prescriverà una terapia antibiotica a base di amoxicillina solubile locale (1 grammo 2 volte/die, per 6 giorni) o, in alternativa nei soggetti allergici, a base di un macrolide (claritromicina 250 mg compresse o bustine, 2 volte/die, per 6-10 giorni), se l’ascesso in via d’organizzazione risultasse inaccessibile.
Pericoronarite
La pericoronarite è l’infiammazione dei tessuti molli attorno alla corona di un dente parzialmente erotto. Essa si osserva comunemente in associazione ai terzi molari mandibolari (denti del giudizio). Lo spazio tra la corona del dente e la gengiva soprastante è la sede ideale per l’accumulo di placca e residui alimentari, con conseguente infiammazione. L’edema infiammatorio causa il rigonfiamento del lembo gengivale che viene traumatizzato dal dente antagonista durante la masticazione, riesacerbando l’infiammazione. La sintomatologia è caratterizzata da dolore e sapore cattivo/amaro, con difficoltà nell’apertura della bocca e nella deglutizione.
In casi gravi, può svilupparsi un ascesso acuto pericoronale che può rimanere localizzato o associarsi a cellulite con diffusione successiva.
Il trattamento della pericoronarite consiste nella rimozione dei residui di cibo al di sotto del lembo gengivale, in lavaggi topici con soluzioni a base di clorexidina allo 0,12% o perossido d’idrogeno (10-12 volumi) diluito con acqua fisiologica e, in caso di riesacerbazioni, nell’estrazione dell’elemento dentario. In tal caso, una terapia antibiotica, solitamente a base di amoxicillina e acido clavulanico (1 gram-mo 2 volte/die), viene somministrata a cominciare dal giorno precedente l’intervento e continuata durante la guarigione, per un totale di 6 giorni.
Gengivite ulceronecrotizzante acuta
La GUNA (gengivite ulceronecrotizzante acuta) è un’infezione endogena opportunistica polimicrobica: una ridotta resistenza dell’ospite a livello locale o generale e una preesistente gengivite cronica predispongono a un eccessivo accrescimento del complesso fusospirochetale.
Colpisce prevalentemente giovani adulti nei paesi industrializzati (forte associazione con immunode-pressione da HIV), quasi esclusivamente i bambini (a causa di povertà e malnutrizione) nei paesi in via di sviluppo. L’infezione si presenta con necrosi e ulcerazione crateriforme delle papille interdentali a insorgenza improvvisa. Le ulcere sono rivestite da pseudomembrane demarcate da una zona di eritema lineare. Altri segni e sintomi includono sangui-namento e dolore gengivale, marcata alitosi (foetor ex ore), scialorrea. Se i fattori predisponenti di base non vengono risolti, il rischio di recidiva è molto alto.
La terapia si prefigge di ripristinare il più velocemente possibile le condizioni ottimali di igiene nella cavità orale, per arrestare la progressione della necrosi e delle ulcere, evitando così danni irreversibili ai tessuti di supporto dei denti. Dato il loro effetto schiumoso, alcune sostanze atomizzate che liberano ossigeno (come ad esempio una soluzione di acqua ossigenata al 3%) si sono dimostrate molto efficaci, se associate alla rimozione strumentale dei depositi duri e molli effettuata facendo attenzione a non ledere i tessuti di sostegno dei denti. Anche l’impiego aggiuntivo di clorexidina in collutorio allo 0,12% o in gel allo 0,2% tre volte al giorno può risultare utile. Nelle prime 24 ore può rendersi necessario il ricorso ad analgesici.
Il paziente deve evitare ogni tipo di irritazione (da fumo, da cibi bollenti o piccanti, ecc). Un miglioramento sensibile si riscontra solitamente nell’arco di 24 ore dopo di che si può procedere a una rimozione più completa delle lesioni. Sebbene la fase acuta risponda bene a vari tipi di antibiotici (da 250 a 500 mg di penicillina VK, 250 mg di eritromicina, 250 mg di una tetraciclina o 250 mg di metronidazolo ogni 8 ore per 5-6 giorni), il loro uso è soltanto di rado necessario e andrà anzi evitato, a meno che non siano presenti febbre alta o segni clinici della diffusione dell’infezione. La distruzione del contorno gengivale che si realizza nella fase acuta può rendere necessaria un’eventuale ricostruzione chirurgica. La perdita delle papille gengivali è generalmente definitiva. La recidiva è improbabile.
Secondaria a infiammazione cronica
Gengivite cronica localizzata e generalizzata
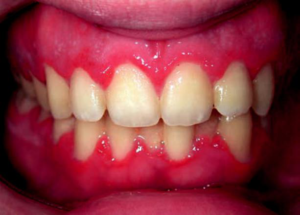
Numerosi fattori eziologici sono responsabili dell’insorgenza di una fl ogosi cronica: scarsa igiene orale con presenza di placca e tartaro, malposizione dentale, respirazione orale, “food impact” e restauri dentali protesici e conservativi incongrui sono tra i principali. A tali fattori va senz’altro associata la risposta immune dell’ospite che determinerà la gravità del quadro clinico. Dal pun-to di vista clinico si riscontrano depositi di placca bat-terica (ed eventualmente tartaro): la gengivite interessa inizialmente il contorno marginale e papillare (fig 2) ma può arrivare a ricoprire parzialmente le corone cli-niche degli elementi dentari. La gengiva si presenta di colore rosso-bluastro, di consistenza morbida e sanguinante sia spontaneamente che dopo lievi sti-moli strumentali, piuttosto che durante le manovre igieniche (spazzolamento, utilizzo del filo interdentale) da parte del paziente (fig. 3)

La maggior parte dei pazienti con gengivite rientra in questa condizione, reversibile se sottoposta ad adeguato trattamento. L’igiene orale professionale rappresenta il trattamento di base e deve essere eseguita con una determinata e personalizzata periodicità. Essa comprende detartrasi, lucidatura, istruzione e motivazione a una corretta igiene orale domiciliare. La detartrasi consiste nella rimozione del tartaro sopra e sottogengivale mediante apposite punte ultrasoniche e strumenti manuali (scaler, curette, ecc). La lucidatura delle corone dentarie prevede, mediante una apposita pasta da profilassi, l’eliminazione dei residui di placca e delle eventuali pigmentazioni esogene (caffè, the, cacao, tabacco ecc).
L’igiene orale domiciliare dovrà basarsi sul corretto utilizzo dello spazzolino (preferibilmente elettrico) per almeno 3 minuti dopo ogni pasto principale e sull’impiego del filo interdentale almeno una volta al giorno. Nei 15 giorni successivi al trattamento professionale il paziente dovrà effettuare sciacqui con collutori a base di clorexidina allo 0,12%. È possibile disinfettare il cavo orale anche con sciacqui a base di acqua ossigenata 10 volumi, diluita al 50% con acqua; il suo utilizzo, oltre che consolidato nel tempo, è sostenuto dalla letteratura internazionale. La terapia chirurgica è indicata solo in quei casi in cui si verifica un’alterazione della morfologia gengivale per fenomeni di fibrosi.
Epulide

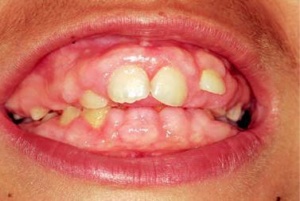
Il termine epulide definisce solo una diagnosi topografica (“sopra la gengiva”) priva di connotazioni istologiche; nella pratica quotidiana è utilizzato per indicare neoformazioni benigne localizzate e originate dai tessuti interdentali. Riconosce come fattori eziologici principali il trauma e l’irritazione cronica provocati soprattutto da placca e tartaro sottogengivali. L’ipotesi di natura ormonale trova un qualche riscontro nella constatazione che la loro insorgenza è più frequente in alcuni casi di squilibrio ormonale (ad esempio lo stato gravidico). È prevalente nel sesso femminile con un rapporto F:M persino su-periore a 2:1. Dal punto di vista classificativo distinguiamo 3 tipi di epulide, a seconda della compo-nente istologica che predomina:
- epulide granulomatosa o granuloma piogenico, con predominanza di tessuto di granulazione aspecifico, vascolarizzato, con segni di elevata attività metabolica (la cosiddetta epulide gravidica, che si verifica in gravidanza, è una forma di epulide granulomatosa); (fig. 4)
- epulide gigantocellulare o epulide vera, con pre-dominanza di cellule macrofagiche con numero-si inclusi amorfi;
- epulide fibromatosa, con predominanza di fibro-cellule connettivali.
Secondo alcuni autori, i vari tipi di epulide corrisponderebbero a stadi diversi di un’unica entità nosologica e sarebbe possibile il passaggio da una forma all’altra partendo dalle forme iniziali più ricche di componente cellulare e vascolare fino a forme ter-minali in cui prevale la componente fibrosa. L’epulide si localizza prevalentemente nei settori anteriori del cavo orale in corrispondenza di uno più elementi dentari e si presenta sotto forma di massa peduncolata o sessile con superficie liscia o lobulata (fig. 5). Frequente è il riscontro di ulcerazioni che possono determinare sanguinamento sponta-neo o dopo stimolo strumentale. La forma è generalmente tondeggiante e il colore variabile dal rosa al rosso-violaceo a seconda della componente istologica prevalente. Alcune volte può associarsi a migrazione degli elementi dentari contigui ed evidenza radiografica di osteolisi (prevalentemente nella forma giganto-cellulare). La terapia, oltre che eziologica, prevede l’escissione chirurgica radicale. In caso di recidive, può rendersi necessaria anche l’avulsione del/i dente/i coinvolto/i.
Gengivite da iperproduzione fibrosa
Fibromatosi gengivale
La fibromatosi gengivale è una infrequente condizione ereditaria trasmessa tramite un gene autosomico dominante.
La predisposizione genetica è comprovata nella forma generalizzata (che si assocerebbe frequentemente a malformazioni di tipo amartomatoso, ipertricosi, epilessia, sordità e ritardo mentale), ma non in quella localizzata, più rara (che non si associa con altre anomalie e presenta un aspetto istologico diverso). Inizia in concomitanza con l’eruzione dei denti permanenti, ma può presentarsi anche durante l’eruzione dei denti decidui. Non sembra avere una predilezione di sesso. Essa è probabilmente il risultato di una anomalia di sviluppo della funzione dei fibroblasti: si può sospettare che il processo flogistico insorgente con l’eruzione dentaria possa determina-re una risposta esuberante su fibroblasti predispo-sti geneticamente.
Clinicamente l’iperplasia inizia in corrispondenza delle papille e del contorno marginale per poi, lentamente, interessare la totalità della gengiva fino a ricoprire le corone dentarie nella forma generalizzata. La gengiva si presenta di consistenza duro-elastica, con aspetto a buccia d’arancia, colore rosa corallo e presenza di pseudotasche. Se si sovrappongono fattori irritativi locali, può apparire rossa e liscia, sanguinare spontaneamente, determinare problemi parodontali. La forma localizzata interessa frequentemente la regione molare sul versante palatino o linguale, con disposizione quasi sempre simmetrica (fibromi ma-scellari periferici simmetrici).
La terapia si basa prevalentemente sulla chirurgia mediante gengivectomia-gengivoplastica e sulla te-apia domiciliare con sciacqui a base di clorexidina allo 0,2% (2 volte/die, per 10 giorni). Nei casi di fibromatosi severa può rendersi necessaria anche l’avulsione degli elementi dentari coinvolti. I casi di fibrosi gene-ralizzata, a differenza della fibrosi localizzata, tendono a recidivare in maniera ricorrente se non controllati periodicamente. L’uso del laser come terapia alternativa a quella chirurgica a lama fredda risale al 1981 con Pecaro e coll. ed è stato in seguito proposto da numerosi autori.



Iperplasie e gengiviti associate a farmaci
Le iperplasie associate a farmaci comprendono quadri clinici che insorgono durante la terapia farmacologica, per azione diretta del farmaco, e regrediscono dopo la sospensione della terapia.
I farmaci chiamati in causa sono:
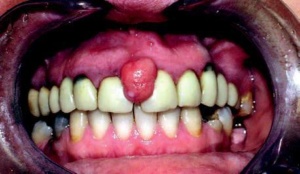
- Difenilidantoina o fenitoina: usata nel trattamen-to dell’epilessia, induce iperplasia nel 40-50% dei casi, soprattutto nei giovani e nei bambini. I primi segni si presentano generalmente dopo 2-3 me-si dall’inizio della terapia, con la massima severità dopo circa 12-18 mesi. (fig. 6)
- Ciclosporina: immunosoppressore usato per pre-venire fenomeni di rigetto dopo un trapianto d’or-gano; causa iperplasia gengivale dopo circa 3-6 mesi di terapia, anche se vengono riportati casi con insorgenza a meno di 1 mese e oltre 1 anno dall’inizio della sua somministrazione. (fig. 7 e 8) dall’inizio della terapia. (fig. 9 e 10)
- Calcio antagonisti: impiegati in varie patologie car-diovascolari, inducono iperplasia in circa il 15% dei casi, con una predilezione per il sesso ma-schile. Essa può verificarsi dopo circa 4-6 mesi dall’inizio della terapia.


Le iperplasie secondarie a farmaci pongono delle problematiche terapeutiche che sono inerenti all’azione del farmaco sul tessuto di sostegno del dente (legamento parodontale), al controllo dei fattori irritativi locali e a un ripristino della morfologia parodontale al fine di favorire un perfetto controllo della placca. Anzitutto è necessario sostituire il farmaco in questione con un altro che non abbia l’iperplasia gengivale come effetto collaterale, a condizione che sia possibile il controllo della patologia primaria. Motiva-re il paziente a una scrupolosa igiene orale e a periodiche sedute di igiene professionale costituisce un prezioso intervento comunicativo sanitario, con indicazione curativa e preventiva, che anche il Far-macista territoriale può effettuare. La clorexidina allo 0,12% in collutorio o l’utilizzazione di fluoruri eventualmente associati all’uso di spazzo-lini elettrici è raccomandabile. Se la morfologia gengivale non consente un ade-guato controllo della placca, si deve attuare una te-rapia chirurgica (gengivectomia, gengivoplastica).
Iperplasie secondarie a malattie sistemiche
L’iperplasia gengivale può associarsi a patologie si-stemiche o a sindromi a carattere familiare, presen-tandosi spesso come primo segno clinico.
Diabete mellito
Il diabete mellito, soprattutto nei pazienti con complicanze retinopatiche e nefropatiche, riducendo la resistenza dei tessuti parodontali o modificandone la risposta ai fattori irritativi locali, determina uno stato di flogosi cronica, correlato alla ridotta fagocitosi e chemiotassi, che può indurre l’iperplasia.
La severità del quadro clinico è anche correlata alle microangiopatie e alle alterazioni del metabolismo del collagene.
Coagulopatie
Altre patologie che possono associarsi all’iperplasia gengivale sono le coagulopatie, in particolare le porpore trombocitopeniche, distinte in idiopatiche o primarie, a patogenesi autoimmunitaria, e secondarie o sintomatiche, correlate a condizioni tossiche, infettive, allergiche, neoplastiche, fisiche o a somministrazione di farmaci. Le manifestazioni orali sono presenti in circa il 60% dei soggetti e uno dei segni clinici più frequenti è una gengivorragia non controllabile. La gengiva è iperplastica, edematosa, rosso-bluastra, con interessamento di entrambe le arcate e, più raramente, in forma localizzata simu-lando il granuloma piogenico. Di frequente riscon-tro sono le macchie emorragiche sul palato e sulle guance. La terapia si baserà sul controllo dei fattori irritativi locali, somministrazione di cortisonici (idro-cortisone o simili) o splenectomia nei casi più gravi (morbo di Werlof).
Sindrome di Sturge-Weber
La sindrome di Sturge-Weber è legata a un gene a penetranza incompleta, senza predilezione di sesso. È una patologia congenita che interessa lo sviluppo della vascolarizzazione con conseguente formazione di malformazioni vascolari a livello cutaneo (fronte o palpebra superiore di uno o entram-bi gli occhi), oculare (glaucoma monolaterale con possibili atrofia ottica e cecità) e sistema nervoso (angiomatosi leptomeningea). L’interessamento di quest’ultimo può esitare in crisi epilettiche ed è responsabile di deficit motori e sensoriali. Con la progressione della malattia i pazienti possono sviluppare emiparesi, emiplegia e disabilità cognitiva variabile. Le manifestazioni orali sono presenti nel 40% dei soggetti e consistono in un’importante iperplasia gengivale localizzata a entrambe le arcate, che può coprire quasi completamente i den-ti e impedire la masticazione, oltre ad associarsi a malposizione dentaria e interessamento osseo. La terapia, oltre al controllo dei fattori irritativi loca-li, è chirurgica (gengivectomia, gengivoplastica).
Granulomatosi di Wegener
La granulomatosi di Wegener è una vasculite necrotizzante dei piccoli vasi caratterizzata dall’associazione tra infiammazione della parete dei vasi e granulomatosi extravascolare. È una malattia rara con un’incidenza annuale di 2-12/1000000, caratterizzata dalla presenza di granulomi nelle alte e basse vie aeree e da una glomerulonefrite focale necro-tizzante. Le manifestazioni orali, presenti nel 50% dei soggetti, sono rappresentate da una crescita esofitica di colore rosso con superficie granulare, che può essere localizzata a livello papillare o generalizzata, coinvolgente entrambe le arcate den-tarie. La terapia eziologica locale va associata a cortisonici e citotossici. Il corticosteroide più usato è il prednisone; tra i farmaci immunosoppressori maggiormente usati si annoverano ciclofosfamide, azatioprina e methotrexate. Anche l’utilizzo dell’anticorpo monoclonale rituxi-mab è stato approvato dall’FDA.
Leucemia
Alterazioni della mucosa orale, soprattutto della gengiva, appaiono quasi regolarmente, e spesso già nei primi stadi della malattia e sono strettamente correlate alle condizioni orali del paziente antecedenti la maattia. I sintomi principali sono rappresentati da:
- necrosi e ulcere (sindrome da ridotta resistenza);
- proliferazione tessutale della gengiva (infiltrato proliferativo leucemico);
- emorragie (diatesi emorragiche trombocitopeni-che o, più raramente, plasmatiche).
La progressiva riduzione dei leucociti funzionali differenziati induce una crescente immunodeficienza. In corrispondenza della mucosa orale già lesionata, i microrganismi penetrano senza alcun impedimento, con la conseguente insorgenza di vaste aree di necrosi e ulcerazione, sostenute dalla trombosi dei piccoli vasi sanguigni.
L’aumento di volume dei tessuti gengivali è la manifestazione di infiltrati o proliferazioni cellulari leucemici nel connettivo sottoepiteliale. La gengiva ha una consistenza pastosa/spugnosa e, in alcuni casi, tende a una rapida distruzione necrotica. Nella leucemia monocitica le lesioni appaiono rosso-scure; nella leucemia linfatica acuta dell’età infantile i sintomi gengivali sono invece più rari, probabilmente a causa di una ridotta incidenza di fattori irritativi locali e di preesistenti alterazioni infiammatorie croniche.
Istiocitosi a cellule di Langerhans o istiocitosi X

È una rara condizione sistemica caratterizzata da proliferazione e accumulo, solitamente sotto for-ma di granulomi, delle cellule di Langerhans in vari tessuti. La sua prevalenza è stimata intorno a 1-2/100000 e, nella maggior parte dei casi, l’e-sordio avviene durante l’infanzia, con una lieve pre-dilezione per il sesso maschile. L’eziologia è tutt’ora sconosciuta: probabilmente si tratta di una malattia reattiva che insorge in risposta a un’infezione virale. Lo scheletro è l’apparato più frequentemente col-pito (80% dei casi), seguito dalla cute (35%) e dala ghiandola ipofisaria (25%). Il coinvolgimento del sistema emopoietico (citopenia), dei polmoni e del fegato è molto meno comune (15-20%) ma peggiora la prognosi. L’incidenza delle localizza-zioni orali, più frequenti negli adulti, varia dal 10 al 35%. Le lesioni istiocitosiche possono interes-sare l’osso mandibolare (lesioni osteolitiche) e, meno frequentemente, il mascellare superiore e la mucosa orale. L’ipertrofia e l’ulcerazione gengivale, che colpiscono prevalentemente i settori dentali po-steriori, possono spesso portare, in associazione al coinvolgimento osseo, alla perdita dei denti (fig. 11).
Gengivite edematosa
Secondaria a modificazioni ormonali
Eziologia
I principali ormoni femminili sono la gonadotropina (HCG), prodotta dall’ipofisi, estrogeno e progesterone, secreti dall’ovaio e dalla ghiandola surrenale. Variazioni dei livelli sierici di tali ormoni si verificano in alcuni periodi della vita:
- nella pubertà l’HCG, stimolando le gonadi, determina la maturazione del sistema riproduttivo con incremento della se-crezione di estrogeni e progesterone;
- nella gravidanza si ha un rapido incremento dell’HCG, che raggiunge il picco massimo verso il 2°-3° mese di gravidanza, per ridursi successivamente; estrogeni e progesterone aumentano pro-gressivamente, presentando un picco all’inizio del 3° trimestre, e si riducono dopo il parto;
- in menopausa l’ovaio diventa meno sensibile all’HCG, con ridotta secrezione di estrogeni enella pubertà l’HCG, stimolando le gonadi, determina la maturazione del sistema riproduttivo con incremento della se-crezione di estrogeni e progesterone; progesterone.
Variazioni del tasso ematico di tali ormoni, presenti anche durante l’uso di contraccettivi orali, determinano un alterato metabolismo tessutale a livello parodontale. L’incremento del fluido gengivale (gravidanza, ovulazione, assunzione di contraccettivi orali) è stato correlato prevalentemente col tasso di progesterone. Esso presenta una più spiccata azione vasale rispetto agli estrogeni in quanto induce incremento della permeabilità vasale, aumento dell’attività proliferava endoteliale, tortuosità del microcircolo con conseguenti stasi circolatoria, aumento della pressione idrostatica e sanguinamento gengivale. Tali dati sottolineano quindi come au-mentati livelli sierici di progesterone predispongano all’infiammazione gengivale o aggravino una infiammazione cronica preesistente.
Gli ormoni steroidei metabolizzati a livello gengivale, possono anche indurre:
- inibizione della proliferazione cellulare (progesterone);
- induzione proliferativa su connettivo ed epitelio gengivale (androgeni ed estrogeni);
- soppressione dell’immunità cellulare (progestero-ne e androgeni);
- stimolazione del sistema immune (estrogeni);
- aumento della sintesi di prostaglandina E2 (progesterone ed estrogeni), favorente i processi flogistici.
Epidemiologica e clinica
Il 30-100% delle donne gravide o sotto terapia estroprogestinica presenta un quadro di gengivite, ma un aumento di volume gengivale localizzato o generalizzato si riscontra solo nel 7-10% dei soggetti. e ancora più bassa è la prevalenza dell’epulide gravidica (1-2%).
Il quadro ormonale e clinico durante la terapia con contraccettivi orali è sovrapponibile a quello osservato in gravidanza: l’edema gengivale è più pronunciato a livello papillare, la gengiva si presenta lucida, rosso-bluastra, con possibili ulcerazioni marginali e pseudomembrane; la consistenza è ridotta, con tendenza al sanguinamento sia spontaneo che du-rante la masticazione o lo spazzolamento.
Il quadro infiammatorio insorge verso la fine del primo trimestre in caso di gravidanza, prevalentemente dopo il terzo mese in caso di terapia con contraccettivi orali. Durante la pubertà vi è un interessamento della sola gengiva vestibolare con un particolare aspeto bulboso delle papille. Frequente è il coinvolgimento dei sestanti anteriori per la presenza di disarmonie occlusali o pronunciato overbite (morso profondo).
Terapia
La normalizzazione dei valori dopo il periodo puberale, il parto o la terapia contraccettiva riduce notevolmente il quadro clinico. Il trattamento si baserà quindi esclusivamente sul controllo dei fattori irritativi locali. La terapia chirurgica dovrà effettuarsi in caso di epulidi, neoformazioni che possono ridursi dopo il parto, ma raramente regredire completamente.
Secondaria a carenza di vitamina C
Lo scorbuto è una patologia correlata al deficit di acido ascorbico o vitamina C, oggi diffuso solo alle popolazioni indigenti e, soprattutto, ai bambini mal-nutriti. È caratterizzato da:
- alterate capacità riparative dei tessuti;
- ridotta resistenza alle infezioni;
- ecchimosi;
- lesioni ossee e muscolari.
La vitamina C agisce sulla formazione e il mantenimento del collagene, componente essenziale dei vasi sanguigni, del tessuto fibroso, dell’osso e della cartilagine. Un suo deficit comporta:
- a livello osseo: ritardo nella formazione di tessuto osteoide, alterata funzione osteoblastica e con-seguente osteoporosi, associati a degenerazione del collagene con edema del tessuto connettivo;
- a livello vasale: aumentata permeabilità, ridotta funzione contrattile dei vasi periferici e tendenza all’emorragia da trauma.
Il deficit di vitamina C non svolge un ruolo prim-rio nella patologia gengivale, ma agisce come fattore esacerbante. Il quadro clinico che si instaura è in realtà collegato a modificazioni della risposta tessutale ai fattori irritativi locali, con interessamento della gengiva papillare e marginale. Essa appare rosso-bluastra, liscia e lucida, di consistenza ridotta, sanguinante anche spontaneamente. La necrosi superficiale, unitamente ai fattori emorragici, deter-mina la presenza di pseudomembrane.
La terapia, oltre al controllo dei fattori irritativi locali, prevede un ripristino dei livelli ematici di acido ascorbico. La somministrazione di 100-250 mg una o due volte al giorno (fino a 1 g/die in caso di deficit severo) di vitamina C è sufficiente per indurre la regressione dei sintomi dello scorbuto nel giro di 1-2 settimane (la gengivite cronica, con estese emorragie sottocutanee, può però persistere più a lungo). Per i venti giorni seguenti è necessario continuare ad assumere con l’alimentazione almeno il doppio della dose giornaliera raccomandata (RDA-consigliata Recommended Daily Allowance) (pari a 60-90 mg/die), e proseguire con la normale dose di mantenimento una volta conclusa la terapia. In ambito preventivo, la profilassi si basa su una dieta che includa il regolare consumo di cibi vegetali cru-di, essendo la vitamina C termolabile (cavoli, broc-coli, cavolfiori, spinaci, fragole, agrumi, peperoni e kiwi consumati crudi).
Altre cause di ipertrofia gengivale
Gengivite desquamativa
Con gengivite desquamativa ci si riferisce a una definizione clinica applicata a particolari manifestazioni gengivali di molte patologie differenti. È più frequente nel sesso femminile e, nella maggior parte dei casi, compare dopo i 30 anni. Clinicamente è caratterizzata da eritema ed edema gengivale, con aree di desquamazione o ulcerazione di estensione variabile. A seconda dell’eziologia, si possono osservare vescicole, bolle, chiazze o strie biancastre. Le gengive vestibolari sono più comunemente colpite. Nella maggior parte dei casi, è in rapporto con patologie del sistema immunitario che colpiscono anche il cavo orale come il lichen planus orale e il pemfigoide delle membrane mucose; altri casi possono rappresentare reazioni di ipersensibilità locale a varie sostanze, come dentifrici, cosmetici, chewing-gum e cannella (utilizzata come aromatizzante alimentare). La reazione gengivale associata a ipersensibilità al chewing-gum è stata anche definita “gengivite plasmacellulare” a causa della diffusa e abbondante presenza di plasmacellule nell’infiltrato infiammatorio.
Sono stati suggeriti molti altri fattori eziologici, poco comuni, tra cui disturbi ormonali nelle donne in menopausa, manifestazioni inusuali di infezioni croni-che, risposte anomale alla placca dentaria. La placca dentaria sicuramente contribuisce a esacerbare l’infiammazione già innescata da altri fattori, pertanto una buona igiene orale domiciliare, supportata da frequente e delicato mantenimento professionale, risulta fondamentale.
Forme cliniche di parodontite
Sono stati descritti quattro tipi principali di parodontite.
 Parodontite prepuberale
Parodontite prepuberale
La parodontite prepuberale è una rara forma di parodontite che si presenta nell’infanzia e interessa la dentizione decidua e, successivamente, quella permanente. È caratterizzata da estesa perdita ossea localizzata (soprattutto molari e incisivi) o generalizata, spesso associata a una serie di malattie sistemiche non frequenti (tabella 2). La maggior parte di queste è caratterizzata da anomalie di numero e/o funzione dei leucociti neutrofili, il che rende i pazienti affetti suscettibili a gravi infezioni sistemiche.
Parodontite giovanile
La parodontite giovanile è una rara forma di parodontite che si presenta in giovane età ed è clinicamente distinta dalla parodontite che interessa gli adulti. Insorge nel periodo della pubertà, fino ai 25-30 anni, e mostra una più alta incidenza nel sesso femminile. La malattia è caratterizzata da rapida distruzione dell’osso alveolare con perdita ossea verticale, e dà luogo a profonde tasche infraossee. Inizialmente vengono colpiti i primi molari permanenti e/o i denti incisivi mascellari, in genere simmetricamente, ma il numero di denti coinvolti aumenta con l’età. Il pattern di interessamento tende a seguire la sequenza dell’eruzione.
L’eziologia e la patogenesi di questa malattia rimangono oscure: la placca batterica gioca un ruolo fondamentale, ma il grado di distruzione non è commi-surato alla sua quantità, solitamente scarsa. La flora subgengivale è, tuttavia, differente rispetto a quel-la della parodontite cronica ed è dominata da bacilli anaerobi Gram negativi, particolarmente da A. acti-nomycetemcomitans.
Oltre alla flora microbica, in diversi casi si è osservata una predisposizione familiare e vi è crescen-te sostegno al sospetto che siano coinvolti an-che fattori genetici. In particolare, una variante del DNA presente frequentemente nella popo-lazione (polimorfismo) che determina una sovrapproduzione del mediatore infiammatorio Interleuchina 1 (IL-1) induce un’eccessiva rispo-sta infiammatoria a livello dell’osso e del tessuto connettivo che circondano il dente, con iperattivazione degli osteoclasti e conseguente riassorbimento osseo aggressivo. Sono stati identificati molti mediatori locali capaci di stimolare l’attività osteoclastica, tra i quali l’lL-1 è probabilmente il più potente, nonché forte induttore di TNFalfa. In questi pazienti, nonostante un’eccellente igiene orale e una bassa percentuale di batte-ri parodontopatogeni, è possibile riscontrare una marcata degradazione dell’osso mascellare associata ad elevati livelli mucosi di IL-1alfa e IL-1beta che attivano la distruzione della matrice extracellulare e dell’osso alveolare.
Parodontite rapidamente progressiva
Meno comune della parodontite giovanile, la parodontite rapidamente progressiva insorge tra i 25 e i 35 anni e manca di caratteristiche ben de-finite. Le lesioni parodontali sono gravi e gene-ralizzate con rapida distruzione ossea nell’arco di poche settimane o mesi. Le gengive possono mostrarsi acutamente infiammate o relativamente normali e il quadro microbiologico è sovrapponibile a quello della fase attiva della pa-rodontite cronica. Generalmente è colpita qua-si tutta la dentizione e la malattia può progredire senza remissione verso la perdita di denti oppure recedere e divenire quiescente. L’eziologia e la patogenesi non sono affatto chiare. Alcuni pazienti mostrano in associazione malessere o perdita di peso, mentre altri mostrano difetti delle funzioni leucocitarie e immunodepressione sistemica.
Parodontite cronica
La parodontite cronica è di gran lunga la forma più frequente di parodontopatia. Esordisce nel giovane adulto, equamente distribuita fra maschi e femmine, ma nella maggioranza dei casi non determina la perdita dei denti fino a dopo i 50 anni. Generalmente è interessata l’intera dentizione con una perdita ossea, prevalentemente orizzontale, soprattutto in zona incisiva e molare.
Dal punto di vista clinico si riscontrano:
- perdita ossea;
- aumento della profondità di sondaggio (misurata mediante sonda parodontale);
- sanguinamento gengivale al sondaggio;
- compromissione delle biforcazioni dei denti (por-zioni del dente pluriradicolato dove le radici si di-vidono);
- eventuale suppurazione infettiva.
Terapia delle patologie gengivali
Terapia causale
La terapia causale delle gengiviti comprende in ogni caso:
- Informazione, istruzione e motivazione del paziente a una corretta igiene orale quotidiana domiciliare. Il controllo meccanico della placca sopragengivale può essere affiancato da un controllo chimico, tenendo però in considerazione il fatto che, a lungo termine, gli agenti chimici antiplacca mostrano una riduzione dei benefici e la comparsa di effetti indesiderati. La clorexidina (in una soluzione allo 0,12-0,2% o in gel) è l’agente antiplacca più efficace e trova indicazione soprattutto quando il paziente non è in grado di eseguire correttamente le manovre di igiene orale meccaniche. La durata del trattamento deve essere limitata a poche settimane a causa degli effetti collaterali reversibili quali ipogeusia (diminuzione della sensibilità gustativa) e pigmentazioni scure dei denti. Questo approccio, unitamente alla stimolazione del paziente a migliorare e a mantenere la propria igiene orale, rappresentano le modalità d’intervento più corrette. L’utilizzo di farmaci naturali per il trattamento della gengivite non è supportato da studi controllati. Inoltre, l’utilizzo di estratti vegetali può causare talvolta reazioni allergiche.
- Rimozione della placca batterica e del tartaro sopragengivale e sottogengivale mediante detartrasi professionale effettuata con strumenti sonici, ultrasonici e manuali.
- Eliminazione di fattori ritentivi di placca sopragengivali e sottogengivali, quali otturazioni e margini protesici debordanti, carie, cemento radi-colare contaminato, per favorire le manovre di igiene orale e per ristabilire un’anatomia dento-gengivale favorevole al controllo della placca.
- Controllo dei fattori che influenzano la progressione della malattia, quali il fumo e il diabete.
I risultati attesi della terapia causale includono:
- miglioramento del livello di collaborazione e parte-cipazione del paziente;
- riduzione significativa e stabile della quantità di placca batterica e tartaro depositati sulle super-fici dentali (al di sotto del 30%);
- eliminazione o riduzione dei segni clinici di infiam-mazione marginale (quali eritema , edema, san-guinamento spontaneo e/o al sondaggio).
Terapia antimicrobica topica
Prima di qualsiasi terapia andrebbero eseguiti test parodontali antimicrobici specifici per individuare i ceppi patogeni e instaurare una terapia mirata. La terapia antimicrobica topica ha lo scopo di ridurre la microflora patogena in siti localizzati che non rispondono alla terapia meccanica; possono essere considerati ausili e non sostituti della terapia meccanica convenzionale. I vantaggi dei prodotti a rilascio locale, rispetto ai farmaci sistemici, sono i seguenti:
- concentrazione efficace del farmaco, per diversi giorni, nel sito infetto,
- minimo “carico” a livello sistemico,
- ridotti effetti collaterali generali sul paziente.
Clorexidina: l’uso di collutori a base di clorexidina allo 0,12% (15ml) per 1 minuto 2 volte/die ha una efficacia sovrapponibile a quella di uno sciacquo di pari durata con 10 ml dello stesso prodotto allo 0,2% 2 volte al giorno, ma effetti collaterali minori. Per concentrazioni inferiori allo 0,12%, l’efficacia è ridotta. La clorexidina è anche disponibile sotto for-ma farmaceutica di gel o spray orale. Queste modalità di somministrazione permettono di veicolare il prodotto direttamente sulle superfici dei denti, rendendo efficace un dosaggio più basso di quello utilizzato per i collutori. L’utilizzo dello spray sembra particolarmente indicato per interventi su aree limitate del cavo orale e nei portatori di handicap fisici o mentali. È importante sottolineare la possibilità di interazione, con possibile inattivazione reciproca, fra la clorexidina e alcune sostanze contenute nei dentifrici e nei collutori, come il sodiolaurilsolfato e il monofluoro fosfato. Pertanto, se ne consiglia l’uso dopo un intervallo di 30 minuti dall’utilizzo di altri prodotti. Sicura nell’uso a lungo termine, dal momento che non crea significative resistenze batteriche, la clorexidina ha mostrato, come precedentemente indicato, effetti collaterali (pigmentazione scura dei denti e delle mucose, alterazione tempo-ranea del gusto e isapore non gradevole) che la rendono inadatta all’uso quotidiano su larga scala.
Fluoruri: una buona capacità di controllo della formazione della placca batterica è stata dimostrata per un prodotto che combina il fluoruro stannoso e l’aminofluoruro, stabilizzati all’interno di una soluzione acquosa. Il collutorio, utilizzato 2 volte/die (10 ml) per 30 secondi, riduce l’accumulo di placca e ri-tarda l’insorgenza della gengivite. Inoltre, risulta ef-ficace nel controllo della placca batterica dopo un trattamento professionale. I composti contenenti fluoruri, inoltre, apportano sulla superficie del dente ioni fluoro con un effetto benefico sulla ipersensibilità dentinale. Gli effetti collaterali sono limitati a una leggera pigmentazione determinata dal fluoru-ro stannoso, peraltro di facile rimozione. Rispetto ai collutori a base di clorexidina, quelli a base di fluoruri pigmentano meno e sono maggiormente graditi dai pazienti.
Prodotti a rilascio sostenuto: hanno una durata di azione di meno di 24 ore e sono necessarie almeno due applicazioni, intervallate da una o più settimane. Di questo gruppo fanno parte il gel di metronidazolo e le microsfere di minociclina. Il metronidazolo è disponibile sotto forma di gel al 25%, contenuto in una siringa. Il prodotto vie-ne introdotto nella tasca, mediante un ago a punta smussa. Le indicazioni d’uso prevedono 2 applica-zioni, a distanza di 7 giorni l’una dall’altra. La minociclina viene proposto sotto forma di microsfere al 25%, contenute in una siringa dotata di un ago a punta smussa.
Prodotti a rilascio controllato: hanno una dura-ta di azione maggiore di 24 ore ed è sufficiente una sola applicazione. Di questo gruppo fanno parte le fibre di tetraciclina, il polimero di doxiciclina. I prodotti a rilascio locale, possono essere utilizzati nelle varie fasi della terapia parodontale, sempre dopo aver provveduto a una rimozione meccanica della placca sottogengivale:
- durante la terapia causale
- dopo la terapia causale, come adiuvante della te-rapia meccanica in zone difficilmente raggiungibili
- durante la terapia di mantenimento e nel tratta-mento delle recidive, sempre in associazione alla strumentazione sottogengivale.
Le fibre di tetraciclina, oggi difficilmente reperibili, sono fibre di etilenvinilacetato, contenenti tetraciclina con una concentrazione del 25%; vengono introdotte nelle tasche parodontali e rimosse dopo circa 10 giorni. La doxiciclina, è disponibile in siringa, sotto forma di gel contenente il principio attivo, all’8,5%. Viene nor-malmente somministrata una sola volta, con l’aiuto di un ago a punta smussa.
A contatto con i fluidi della tasca parodontale, il prodotto solidifica, impedendo al farmaco di uscire. È stato recentemente proposto un protocollo di trattamento delle parodontiti croniche, che prevede la strumentazione semplificata delle tasche mediante strumenti a ultrasuoni in una singola seduta, seguita da applicazione del polimero di doxiciclina. L’approccio farmaco-meccanico proposto determina anche significativa riduzione del tempo terapeutico rispetto all’approccio meccanico convenzionale.
In letteratura sono stati proposti altri prodotti, contenenti sanguinarina, sali metallici (rame, stagno e zinco), composti di ammonio quaternario (ioduro di cetilpiridinio), agenti ossidanti (perossiborato, perossicarbonato), la cui efficacia clinica necessità però di ulteriore validazione scientifica.
Terapia antimicrobica sistemica
L’obiettivo della terapia sistemica è concorrere alla massima riduzione dei microrganismi patogeni parodontali, nelle seguenti situazioni cliniche:
- ascessi parodontali,
- parodontiti a insorgenza precoce,
- gengivite necrotizzante,
- pericoronarite recidivante,
- ulcere gengivali.
Eccezione fatta per le infezioni acute, gli antibiotici devono essere somministrati solo dopo un’accurata terapia meccanica e in presenza di un controllo ottimale della placca batterica da parte del paziente. È auspicabile che il loro utilizzo sia supportato anche da una diagnosi microbiologica che permetta la scelta più appropriata. Tuttavia, può essere giustificato un approccio empirico di fronte a infezioni parodontali nei casi in cui non sia possibile eseguire tali esami e il clinico ritenga importante la terapia antibiotica aggiuntiva. Vari sono i regimi terapeutici, monoterapici o in associazione, proposti in letteratura nelle diverse situazioni cliniche:
- parodontiti a insorgenza precoce: tetracicli-na-HCL, 250 mg 4 volte/die per 14 giorni oppure metronidazolo+amoxicillina (250 mg 3 vol-te/die + 375/500 mg 3 volte/die per 7-10 giorni),
- gengiviti e parodontiti necrotizzanti: metronidazo-lo, 250 mg 3 volte/die per 7 giorni,
- parodontiti refrattarie al trattamento meccanico (in mancanza di esami microbiologici completi): metronidazolo+ amoxicillina99-101 (250 mg 3 volte/die + 375/500 mg 3 volte/die per 8 giorni) oppure metronidazolo+ ciprofloxacina (250 mg 3 volte/die + 500 mg 2 volte/die per 8 giorni) in caso di allergia alle ß-lattamasi; questa associazione è comunque indicata in caso di infezioni miste da anaerobi, Actinomyces, ba-stoncelli enterici e Pseudomonas.
- Ascessi parodontali: in caso di emergenza, la penicillina rappresenta il farmaco di prima scelta, metronidazolo o amoxicillina clavulanato rappresentano le scelte alternative; in caso di fallimento della terapia e in presenza dell’ esame microbiologico, le modifiche al regime terapeutico devono basarsi sul quadro clinico, sul profilo microbiologico e sull’eventuale test di sensibilità agli antibiotici. In caso di fallimento della terapia e in assenza di esame microbiolo-gico è indicata la sostituzione con un antibiotico a più ampio spettro come l’amoxicillina clavulanatoo la clindamicina:questa ultima è raccomandata in caso di allergia alla penicillina.
- Altri farmaci proposti: ciprofloxacina, clindamicina, doxiciclina (tabella 3).

La continua emergenza di specie batteriche antibiotico-resistenti rende, tuttavia, necessario un uso sempre più razionale degli antibiotici anche per le patologie gengivali e parodontali. L’utilizzo di tecniche di diagnostica microbiologica e di test di sensibilità, quando possibile, è fortemente raccomandato.
Terapia corticosteroidea
L’idrocortisone può essere utile in caso di gengivite se applicato localmente, sotto forma di crema o pasta dentale, 2 o 3 volte al giorno, dopo i pasti e prima di andare a dormire. In generale, si consiglia di applicare un’ulteriore dose abbondante di farmaco senza farlo assorbire, in modo da creare una sorte di pellicola protettiva sulla superficie del dente. L’idrocortisone è spesso reperibile in associazio-ne ad antibiotici, come neomicina e polimixina B.
Terapia antinfiammatoria
I FANS (farmaci antinfiammatori non steroidei) indicati per ridurre l’infiammazione delle gengive gonfie e alleviare il dolore sono:
- ketoprofene, collutorio o spray allo 0,16%,
- flurbiprofene, collutorio o spray allo 0,25%,
- naproxene, collutorio o spray allo 0,223%.
Disponibili in collutorio o spay per mucosa orale, prevedono da 2 a 4 sciacqui o spruzzi al giorno, in base alla sintomatologia.









